题目内容
7. 在密闭容器中,反应X2(g)+Y2(g)?2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( )
在密闭容器中,反应X2(g)+Y2(g)?2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( )| A. | 可能是减小了反应物的浓度,反应物X2转化率一定减小 | |
| B. | 可能是加入了催化剂,反应物X2百分含量(X2%)将增大 | |
| C. | 可能是缩小了容器的体积,但该反应的平衡常数保持不变 | |
| D. | 可能是升高了温度,该反应的平衡常数一定减小 |
分析 由反应X2(g)+Y2(g)?2XY(g),△H<0,则该反应为反应前后体积不变的反应,由图可知改变某一条件后,达到乙平衡,达到平衡的时间短了,XY的含量降低了,说明反应速率加快,平衡向逆反应方向移动,据此分析.
解答 解:A、减小反应物浓度,化学反应速率减慢,故A错误;
B、加入正催化剂,正逆反应速率同等程度的增大,化学平衡不移动,故B错误;
C、反应X2(g)+Y2(g)?2XY(g)为反应前后体积不变的反应,若缩小了容器的体积即增大压强,正逆反应速率同等程度的增大,但化学平衡不移动,故C错误;
D、由图象可知乙的温度大于甲的温度,升高温度化学平衡逆向移动,XY的含量减小,平衡常数一定减小,故D正确.
故选:D.
点评 本题考查化学反应速率、化学平衡与图象的关系,明确影响因素及图象中纵横坐标的含义、点与线的含义是解答本题的关键.

练习册系列答案
相关题目
17.下列关于反应速率的说法错误的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 可逆反应达到化学平衡状态时,正、逆反应速率都为0 | |
| C. | 决定反应速率的主要因素是反应物的性质 | |
| D. | 增大反应物浓度,提高反应温度都能增大反应速率 |
18.在下列反应中,光照对反应几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 氟气与氢气的反应 | D. | 次氯酸的分解 |
15.下列从混合物中分离出其中的一种成分,所采取分离方法正确的是( )
| A. | 由于碘在酒精中的溶解度大,所以,可用酒精把碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以,可用加热蒸馏方法使含水酒精变成无水酒精 | |
| C. | 氯化钠的溶解度随着温度下降而减少,所以,用冷却法从热的含有少量硝酸钾浓溶液中得到纯净的氯化钠晶体 | |
| D. | 在实验室中,通常采用加热氯酸钾和二氧化锰的混合物方法制取氧气.我们可以用溶解.过滤的方法从反应产物中得到二氧化锰 |
2.下列实验操作正确的是( )
| A. |  点燃酒精灯 | B. |  干燥氢气 | C. |  检查气密性 | D. |  测定溶液的pH |
12.下列说法正确的是( )
| A. | 原子核外电子层数越多,原子半径越大 | |
| B. | 每一主族所含非金属元素的种类可表示为︳族序数-2? | |
| C. | 根据泡利原理将氧元素基态原子的电子排布图书写为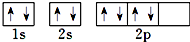 | |
| D. | C2H2分子中的碳采取sp2杂化 |
19.x、y、z三种元素的离子具有相同的电子层结构,离子半径x>y,y与z可形成zy2型离子化合物,则3种元素的原子序数关系是( )
| A. | x>y>z | B. | y>x>z | C. | z>x>y | D. | z>y>x |
16.某原子的原子核外最外层电子排布为ns2np4,按照共用电子对理论,该原子一般可形成共用电子对的数目是( )
| A. | 1对 | B. | 2对 | C. | 3对 | D. | 4对 |
17. 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )| A. | 咖啡酸的分子式为C9H8O4 | |
| B. | 1mol咖啡酸可以和含4molBr2的浓溴水反应 | |
| C. | 1mol咖啡酸可以和3molNaOH反应 | |
| D. | 可以用高锰酸钾检验出咖啡酸分子中含有碳碳双键 |