题目内容
下列陈述和判正确、并且有因果关系的是
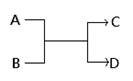
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液肯定含有SO42- |
| C | 在金属活动顺序表中,金属活动顺序:Fe>H>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,汞和银只需加热,而铁和铜必须用还原剂 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
C
解析试题分析:A选项光导纤维的主要材料是二氧化硅,因此A选项是错误的。
B选项,白色沉淀有可能是氯化银,因此B选项是错误的。D选项,新猛干电池属于一次性电池,不可以反复使用。所以答案选D
考点:考查化学的基本概念和基本理论的相关知识点

练习册系列答案
相关题目
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② | | | |
| | | ⑦ | ⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是 ,②元素的氧化物的电子式是 ,②与⑧形成的化合物中存在的化学键是 ,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是 (用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是 (用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
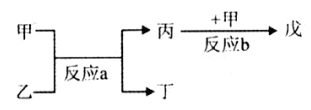
①写出反应a的化学方程式: 。
②写出戊与丁反应的化学方程式: 。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。
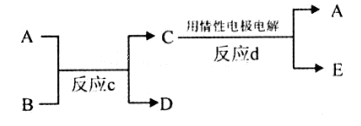
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为: 。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为 。
2014年2月,我国中东部地区遭遇严重的雾霾天气,京津冀地区的空气污染级别高达6级,PM2.5值逼近1000(“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物).下列有关环境污染与防护的说法正确的是 ( )
| A.CO2、NO、NO2都是大气污染气体,在空气中能稳定存在 |
| B.使用清洁能源是防止酸雨发生的重要措施之一 |
| C.PM2.5属于胶体,可以通过静电除尘装置除去 |
| D.治理汽车尾气中的CO和NO2,可以通过催化转化装置,转化成无毒的CO2和NH3 |
下列实验中,所加固体可以完全溶解的是
| A.在H2O2溶液中加入少量MnO2粉末 |
| B.将一小块铝片投入足量NaOH溶液中 |
| C.将少量氢氧化铝加入足量的浓氨水中 |
| D.常温下将一小块铁片投入足量的浓硝酸中 |
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况,下列反应中属于这种情况的是
①过量的Zn与18 mo1/L硫酸溶液反应;②过量的氢气与少量的氮气在催化剂存在一定条件下充分反应;③过量的水与一定量氯气;④过量的铜与浓硫酸;⑤过量的铜与稀硝酸; ⑥过量的稀硫酸与块状石灰石;⑦常温下过量浓硫酸与铝
| A.②③⑤ | B.②③④⑥⑦ | C.①④⑤ | D.①②③④⑤ |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |