题目内容
以下是反A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是
- A.v(A)="0.15" mol?L-1?s-1
- B.v(B)="0.6" mol?L-1?s-1
- C.v(C)="0.4" mol?L-1?s-1
- D.v(D)="0.45" mol?L-1?s-1
D
试题分析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值即可。根据反应的方程式,如果都用物质B表示,则反应速率分别是0.45 mol/ (L·s)、0.6 mol/ (L·s)、0.6 mol/ (L·s)、0.675mol/ (L·s),答案选D。
考点:考查反应速率的有关计算和大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的应试能力和学习效率。该题的关键是明确反应速率和化学计量数的关系。另外再进行反应速率的换算时,还要注意单位的统一。
试题分析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值即可。根据反应的方程式,如果都用物质B表示,则反应速率分别是0.45 mol/ (L·s)、0.6 mol/ (L·s)、0.6 mol/ (L·s)、0.675mol/ (L·s),答案选D。
考点:考查反应速率的有关计算和大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的应试能力和学习效率。该题的关键是明确反应速率和化学计量数的关系。另外再进行反应速率的换算时,还要注意单位的统一。

练习册系列答案
相关题目
(12分)Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
在实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
| | 乙醇 | 1,2二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
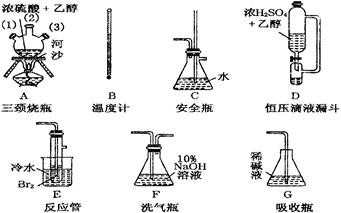
(2)温度计水银球的正确位置是 。
a、支管口处 b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
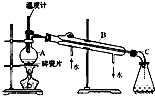 (1)实验室分馏石油的正确操作顺序是:A→
(1)实验室分馏石油的正确操作顺序是:A→