题目内容
(2009?肇庆一模)已知的Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38,Cu2+和Fe3+完全以氢氧化物沉淀时的pH分别为:6.7和3.2.现在向pH=0、浓度均为0.04mol?L-1 的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),该过程中Cu2+、Fe3+的浓度与pH关系正确的是( )
分析:依据已知的Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38,Cu2+和Fe3+完全以氢氧化物沉淀时的pH分别为:6.7和3.2;现在向pH=0、浓度均为0.04mol?L-1 的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),所以加入固体提高溶液PH到3.2,氢氧根离子浓度增大,使Qc大于Ksp,三价铁离子能沉淀完全,过程中该过程中Cu2+、Fe3+的浓度与pH关系依据图象和反应原理分析判断;Ksp[Fe(OH)3]=4.0×10-38.
解答:解:Ksp[Fe(OH)3]=4.0×10-38,=[Fe3+][OH-]3,计算得到[OH-]=10-12mol/L;三价铁离子开始生成沉淀的PH=2,所以铁离子开始沉淀到沉淀完全的PH范围为2-3.2;
A、溶液PH为达到3.2,铁离子不能沉淀完全,开始沉淀的PH错误,故A错误;
B、溶液PH等于3.2时三价铁离子全部沉淀,铁离子浓度减小,故B正确;
C、PH符合三价铁离子全部沉淀的条件,铁离子浓度减小,故C错误;
D、PH符合三价铁离子全部沉淀的条件,铁离子浓度减小,开始沉淀的PH产物,故D错误;
故选B.
A、溶液PH为达到3.2,铁离子不能沉淀完全,开始沉淀的PH错误,故A错误;
B、溶液PH等于3.2时三价铁离子全部沉淀,铁离子浓度减小,故B正确;
C、PH符合三价铁离子全部沉淀的条件,铁离子浓度减小,故C错误;
D、PH符合三价铁离子全部沉淀的条件,铁离子浓度减小,开始沉淀的PH产物,故D错误;
故选B.
点评:本题考查了沉淀溶解平衡的分析计算应用,离子分子提纯的方法应用,关键是离子沉淀的pH判断,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
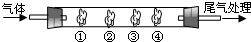
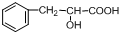 (2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下:
(2009?肇庆一模)有机物A是一种重要化工生产的中间体,其结构简式如下: