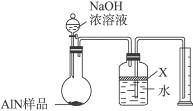
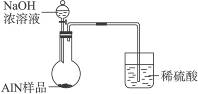
题目内容
图所示的实验装置或操作不能达到实验目的是( )


| A.① | B.② | C.③ | D.④ |
A、氯化铵受热分解产生的氨气和氯化氢气体在试管口处会化和生成氯化铵固体,不会获得氨气,故A错误;
B、可用100mL的容量瓶来配置100mL0.1mol/L的盐酸溶液,故B正确;
C、根据量热计的构造,该装置类似于量热计的结构,可以进行中和反应反应热的测定,故C正确;
D、实验室用乙醇和乙酸以及浓硫酸在加热条件下制取乙酸乙酯,乙酸乙酯在饱和碳酸钠中的溶解度很小,可以用饱和碳酸钠来吸收,导管伸到溶液的上方,故D正确.
故选A.
B、可用100mL的容量瓶来配置100mL0.1mol/L的盐酸溶液,故B正确;
C、根据量热计的构造,该装置类似于量热计的结构,可以进行中和反应反应热的测定,故C正确;
D、实验室用乙醇和乙酸以及浓硫酸在加热条件下制取乙酸乙酯,乙酸乙酯在饱和碳酸钠中的溶解度很小,可以用饱和碳酸钠来吸收,导管伸到溶液的上方,故D正确.
故选A.

练习册系列答案
相关题目