题目内容
Al、Cu都是重要的金属元素。下列说法正确的是
| A.两者对应的氧化物均为碱性氧化物 |
| B.两者的单质都能与稀硫酸反应产生氢气 |
| C.常温条件下,两种金属都能溶解于浓硝酸中 |
| D.用惰性电极电解AlCl3、CuCl2的水溶液均可得到氯气 |
D
解析试题分析:A、Cu2O不是碱性氧化物,错误;B、Cu的金属活泼性在H之后,不能与稀硫酸反应生成氢气,错误;C、常温时,Al在浓硝酸中钝化,错误;D、用惰性电极电解AlCl3、CuCl2的水溶液,阳极Cl?失电子生成氯气,正确。
考点:本题考查金属Al、Cu的性质、电解反应产物的判断。

 名校课堂系列答案
名校课堂系列答案为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它
①热稳定性差②增加甜味③产生二氧化碳④提供钠离子。其中合理的是
| A.②③ | B.①③ | C.①④ | D.③④ |
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,固体残留物组成不可能是( )
| A.NaOH和Na2CO3 | B.Na2O2、NaOH和Na2CO3 |
| C.NaOH | D.Na2CO3 |
碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是:
| A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间 |
| B.“侯氏制碱法”制得的碱是指NaHCO3 |
| C.可用盐酸鉴别Na2CO3和NaHCO3固体 |
| D.纯碱有时可代替烧碱使用,比如溶解石英、促进乙酸乙酯的水解等 |
金属钠着火时,可用来灭火的是
| A.二氧化碳 | B.水 | C.煤油 | D.沙土 |
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )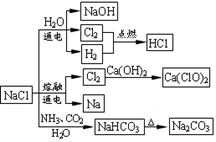
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2与铁不反应 |
| D.图中所示转化反应都是氧化还原反应 |
(12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: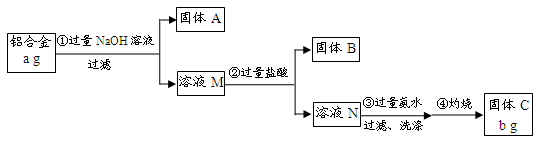
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
