题目内容
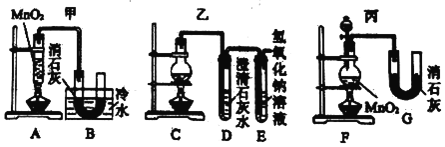
【题目】为探究SO2的化学性质,设计了如图系列实验。

(1)①中开始时无现象,放置一段时间后,出现白色浑浊,写出有关的三个反应的化学方程式:___、___、___;
(2)③中发生反应后的铁元素的价态为___。
(3)试写出④⑤中反应的离子方程式:___、___。
(4)若通入的气体改为CO2,那么①②③④中哪个会出现与SO2不同的现象?___(填序号)。
【答案】SO2+H2O=H2SO3 2H2SO3 +O2=2H2SO4 BaCl2+H2SO4=BaSO4↓+2HCl +2 5SO2+2MnO4-+2H2O=4H++5SO42-+2Mn2+ SO2+2OH-=SO32-+H2O ①②③④
【解析】
二氧化硫与水反应生成亚硫酸,亚硫酸酸性比盐酸弱,①开始无现象,亚硫酸可被氧气氧化生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,②中品红褪色,③④用于检验二氧化硫的还原性,⑤可用于吸收二氧化硫,避免污染环境。
(1)①中开始时无现象,放置一段时间后,出现白色浑浊,发生了三个反应:二氧化硫与水的反应、亚硫酸被氧化生成硫酸以及硫酸与氯化钡的反应,方程式为SO2+H2O=H2SO3、2H2SO3 +O2=2H2SO4、BaCl2+H2SO4=BaSO4↓+2HCl,
故答案为:SO2+H2O=H2SO3、2H2SO3 +O2=2H2SO4、BaCl2+H2SO4=BaSO4↓+2HCl;;
(2)③中发生反应:氯化铁具有氧化性,可与二氧化硫发生氧化还原反应生成硫酸和亚铁离子,生成物为氯化亚铁,化合价为+2价,
故答案为:+2;
(3)④中高锰酸钾将二氧化硫氧化发生5SO2+2MnO4-+2H2O=4H++5SO42-+2Mn2+,⑤中二氧化硫与碱反应生成盐和水,发生SO2+2OH-=SO32-+H2O,
故答案为:5SO2+2MnO4-+2H2O=4H++5SO42-+2Mn2+;SO2+2OH-=SO32-+H2O;
(4)若通入的气体改为CO2,二氧化碳与①②③④中溶液都不反应,没有明显现象,故答案为:①②③④。

【题目】在1 L容器中用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)![]() 2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2 min的反应速率小于4~6 min的反应速率
B. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200 ℃)<K(400 ℃)