题目内容
| |||||||||||||||||||||||||||||||||||||
解析:
(1) |
答案: 解析:平衡常数为各生成物浓度的系数次方的乘积与各反应物浓度的系数次方的乘积的比值,因此本反应的K= |
(2) |
答案:b 1.5×10-3 mol/(L·s) 解析:根据反应方程式:2NO(g)+O2(g) 0~2 s内,v(NO)= 因此v(O2)= |
(3) |
由于该反应为体积减小的反应,当容器的压强保持不变,说明反应已达平衡;v逆(NO)=2v正(O2)=v正(NO),因此可以说明反应达到平衡;由于气体的质量不变,容器的体积不变,因此密度始终不变,故密度不变,不能说明反应已达平衡. |
(4) |
及时分离出NO2气体,降低了生成物的浓度,因此反应速率降低;由于正反应为放热反应,因此升高温度平衡向左移动;而催化剂仅改变反应速率不能使平衡发生移动,因此A、B、D均不正确;只有C增大反应物O2的浓度,v正增大,v逆随之增大,平衡正向移动. |

 阅读快车系列答案
阅读快车系列答案在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
(9分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
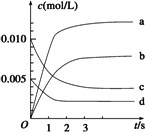
(2)图中表示NO2的变化的曲线是________.用O2表示从0~2 s内该反应的平均速率v=________
(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
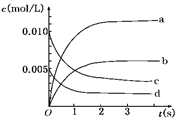
(3)右图中表示NO2变化的曲线是 ;

(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
(12分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  ?2NO2(g)体系中,n(NO)随时间的变化如下表:
?2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
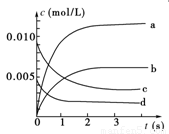
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____ ___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂