题目内容
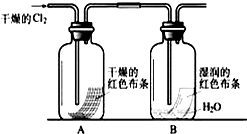 某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验.
某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验.①写出Cl2与水反应的离子方程式
②通入Cl2后,从集气瓶A、B的现象可得出的结论是
考点:氯气的化学性质
专题:卤族元素
分析:①Cl2与水反应生成次氯酸和盐酸,其中的水和次氯酸都弱电解质;
②通入Cl2后,干燥的氯气没有漂白性,生成的HClO漂白性,由此分析解答.
②通入Cl2后,干燥的氯气没有漂白性,生成的HClO漂白性,由此分析解答.
解答:
解:①Cl2与水反应生成次氯酸和盐酸,离子方程式为Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO;
②通入Cl2后,干燥的氯气没有漂白性,而B中生成的HClO漂白性,氯气有毒,环保角度考虑,最后要加尾气处理装置,故答案为:干燥的氯气没有漂白性,氯水有漂白性;尾气吸收装置.
②通入Cl2后,干燥的氯气没有漂白性,而B中生成的HClO漂白性,氯气有毒,环保角度考虑,最后要加尾气处理装置,故答案为:干燥的氯气没有漂白性,氯水有漂白性;尾气吸收装置.
点评:本题考查氯气的性质结合离子反应的书写、氯水的漂白性和毒性,比较基础,学生容易解答.

练习册系列答案
相关题目
下列叙述正确的是 ( )
| A、向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 |
| B、向FeSO4溶液中通入过量CO2,有浑浊现象产生 |
| C、SO2具有漂白性,常用于自来水消毒 |
| D、Fe和Br2混合加热生成FeBr2 |
由乙醇制取乙二酸乙二酯,最简便的流程途径顺序正确的是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应⑦中和反应 ⑧缩聚反应.
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应⑦中和反应 ⑧缩聚反应.
| A、⑤②①③⑥ |
| B、①②③④⑤⑦ |
| C、⑤②①③⑧ |
| D、①②⑤③⑥ |
下列对有关物质性质的分析正确的是( )
| A、IBr可与水反应生成HIO和HBr |
| B、在高温下用氢气还原MgCl2可制取金属镁 |
| C、Na久置于空气中,最终生成NaHCO3 |
| D、打开盛浓盐酸的试剂瓶可看到白色的雾,说明HCl不稳定 |
把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是( )
| A、加入适量CH3COONa溶液 |
| B、加入适量KNO3溶液 |
| C、加入适量的K2CO3溶液 |
| D、加入适量Na2SO4溶液 |
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生如下反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生如下反应:A(g)+B(g)?x C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C 的浓度随时间变化如图所示.下列说法正确是( )
| A、反应方程式中的x=1 |
| B、t1~t3间该反应的平衡常数均为4 |
| C、t3时刻改变的条件是移去少量物质D |
| D、t3时刻改变的条件是使用催化剂 |
配制500mL 1mol/LHCl溶液时,不需要的仪器是( )
| A、容量瓶(500mL) |
| B、分液漏斗 |
| C、烧杯 |
| D、胶头滴管 |
按如图所示装置进行下列不同的操作,其中不正确的是( )
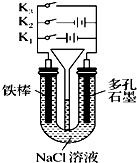

| A、只接通K1,一段时间后,U形管中出现白色沉淀 |
| B、只接通K2,U形管左、右两端液面均下降 |
| C、若U形管左、右两端上方充入一些空气,铁腐蚀的速度由大到小的顺序是:只接通K1>只接通K3>都断开>只接通K2 |
| D、若将氯化钠溶液改为氢氧化钠溶液,铁棒改为多孔石墨,先只接通K2,一段时间后,漏斗内液面上升,然后再只接通K3,则接通K3后装置中无电流通过 |