题目内容
元素铝是在生产、生活中应用广泛的金属元素。
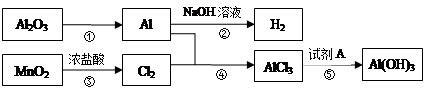
(1)从矿石提取氧化铝:矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝。降温析出晶体时的反应方程式为: 。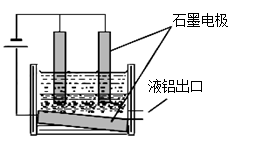
(2)氧化铝是工业电解冶炼铝的重要原料,生产中加入冰晶石(Na3AlF6),其作用是 。
工业冶炼铝的装置示意图如右:
①阴极的反应式 ,
②在电解池工作过程中,需要不断补充阳极材料,原因是 。
(3)有资料介绍:溶液中铝元素以氢氧化物[用Al(OH)3表示]形式存在的pH范围是3.8~10。现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 。
(4)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。有关PAFC的说法正确的是 。(填选项)
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中都能稳定存在
31.(8分)
(1)NaAl(OH)4=Al(OH)3↓+NaOH (1分)。
(2)作(助)熔剂(降低氧化铝熔点,使其在1000℃左右即可熔化)(1分)。
①Al3++3e-="Al" ;(1分)。
②电解阳极产生O2,在高温条件下,石墨阳极被不断的氧化为CO2。(2分)。
(3)Al3++3[Al(OH)4]-=4Al(OH)3↓(或Al3++3AlO2-+6H2O=4Al(OH)3↓) (1分)。
(4)①BC (2分)。
解析试题分析:
(1)从题目后面可以推出再经净化和高温煅烧得到氧化铝。说明有Al(OH)3↓生成,因此反应可以写为NaAl(OH)4=Al(OH)3↓+NaOH 。
(2)由于氧化铝熔点非常高,要加热使其熔化需要很高的温度即消耗大量的能源,生产中加入冰晶石(Na3AlF6),作(助)熔剂(降低氧化铝熔点,使其在1000℃左右即可熔化)可以使其在较低温度下熔化,起始节约能源作用。
①阴极是阳离子得电子的反应,所以的反应式Al3++3e-="Al" ;
②在电解池工作过程中,电解阳极产生O2,在高温条件下,石墨阳极被不断的氧化为CO2。
(3)弱酸的阴离子和弱碱的阳离子在水溶夜中时会发生双水解反应,可以写为Al3++3[Al(OH)4]-=4Al(OH)3↓(或Al3++3AlO2-+6H2O=4Al(OH)3↓)。
(4)由于PAFC的相对分子质量比较大,相同质量时其阳离子的量较少,离子水解时产生的氢离子浓度较小,因此比用相同量的氯化铝和氯化铁对水的pH改变小,另外该物质是一种碱式盐,相当于部分阳离子得到水解,故答案选择BC 。

(14分)某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制氯水 | B.有气体产生,溶液变成浅红色 |
| ③将金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应较快,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E. 生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究同周期元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,
AlCl3溶液,NaOH溶液等。
仪器: , ,烧杯,试管,试管夹,镊子,小刀,玻璃片等。
(3)实验内容:(完成实验步骤对应的实验现象的标号和离子方程式)
| 实验步骤 | 实验现象 | 离子方程式 |
| ① | | (不需填写) |
| ② | | |
| ③ | | |
| ④ | C | (不需填写) |
| ⑤ | D | |
| ⑥ | | |
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下: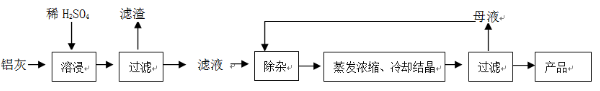
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的 ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式 ;
③Ⅲ中加入MnSO4的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 (填化学式)。