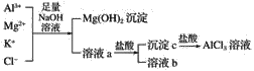
题目内容
【题目】三氯化钌是一种重要的贵金属化合物,广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。
I.三氯化钌的制备
将金属钌粉与氯化钠混合后,加入微量还原性淀粉,将温度升高到800~1000°C,再往熔融的熔体中通入氯气,大部分钌粉转化为氯钌酸钠(Na2RuCl6),再经过一系列化学工艺制备出三氯化钌。
(1)生成氯钌酸钠的化学方程式为__________________
(2)升温阶段加入还原性淀粉的作用是__________________
II.三氯化钌的回收
从废弃催化剂回收三氯化钌的一种工艺流程如下图所示:
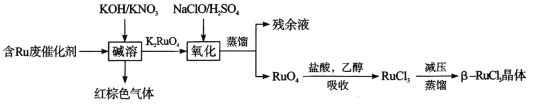
回答下列问题:
(3)“氧化”时加H2SO4的目的______________________
(4)“吸收”过程中加入乙醇的作用是__________________________
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2==2Ru+6HCl。某同学对产品纯度进行测定,所得数据记录如下:

则产品的纯度为________(用百分数表示,保留两位有效数字)
(6)钌及其化合物在合成工业.上有广泛用途,下图是用钌( Ru)基催化剂催化合成甲酸的过程。每生成92g液态HCOOH放出62.4kJ的热量。
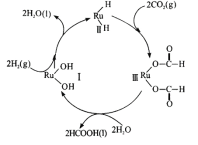
①根据图示写出该反应的热化学方程式_______________
②下列说法正确的是________
a.图示中物质I为该反应的催化剂
b.图示中参与循环的物质只有CO2和H2
c.反应的活化能为62.4 kJ·mol -1
【答案】Ru+2Cl2+2NaCl![]() Na2RuCl6 保持还原性反应环境,防止金属钌被空气中氧气氧化 NaClO在酸性环境下氧化性增强 增加RuO4在溶液中的溶解性 82% H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 a
Na2RuCl6 保持还原性反应环境,防止金属钌被空气中氧气氧化 NaClO在酸性环境下氧化性增强 增加RuO4在溶液中的溶解性 82% H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 a
【解析】
II.含Ru废催化剂加入KOH/KNO3混合溶液浸取,硝酸根在碱性环境下将Ru元素氧化为K2RuO4,自身被还原成红棕色气体NO2,之后再加入硫酸酸化的次氯酸钠,将K2RuO4氧化为RuO4,蒸馏得到RuO4,加盐酸和乙醇混合液进行吸收,得到RuCl3溶液,之后进行减压蒸馏得到β—RuCl3晶体;
Ⅲ.H2和物质I反应生成水和物质Ⅱ,之后物质II和CO2反应生成物质Ⅲ,之后物质Ⅲ和水反应生成物质I和HCOOH,所以物质I为催化剂,氢气和二氧化碳为反应物
I.(1)根据题意反应物有Ru、NaCl以及氯气,产物有Na2RuCl6,该过程中Ru元素被氧化成+4价,Cl元素被还原成-1价,根据电子守恒和元素守恒可得化学方程式为Ru+2Cl2+2NaCl![]() Na2RuCl6;
Na2RuCl6;
(2)空气中的氧气具有氧化性,升温阶段加入还原性淀粉可以保持还原性反应环境,防止金属钌被空气中氧气氧化;
II.(3)酸性环境下可以增强NaClO的氧化性;
(4)加入乙醇可以增大RuO4在溶液中的溶解度;
(5)根据三组实验数据得到的Ru单质的平均质量为![]() =0.500g,根据方程式可知样品中RuCl3的质量为
=0.500g,根据方程式可知样品中RuCl3的质量为![]() =1.0272g,则样品的纯度为
=1.0272g,则样品的纯度为![]() =82%;
=82%;
(6)①根据整个流程可知,CO2和H2为反应物,产物为HCOOH,92gHCOOH的物质的量为![]() =2mol,所以生成1mol液体HCOOH放出31.2kJ能量,热化学方程式为H2(g)+CO2(g)=HCOOH(l)△H=-31.2kJ·mol-1;
=2mol,所以生成1mol液体HCOOH放出31.2kJ能量,热化学方程式为H2(g)+CO2(g)=HCOOH(l)△H=-31.2kJ·mol-1;
②a.据图可知物质I虽然参与整个过程,但整个反应前后没有变化,且反应从物质I和氢气的反应开始,所以为该反应的催化剂,故a正确;
b.据图可知催化剂虽然整个过程前后质量和化学性质没有变化,但也参与了整个循环,故b错误;
c.每生成2mol HCOOH放出62.4kJ的能量,据此可知反应物和生成物的能量之差,不能确定反应的活化能,故c错误;
综上所述选a。

【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
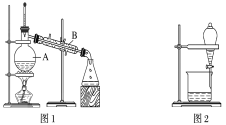
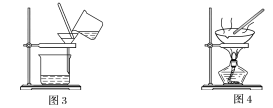
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。