题目内容
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)铝热反应在工业生产中的重要用途之一是_________________;用化学方程式表示出其中的原理________________________________________(举一例)。铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为____________________________________。
(2)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是____________(写化学式)。缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_______________。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是_________。(用化学方程式表示)。
(4)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO。
①在化学方程式上标出该反应中电子转移的方向和数目。_________
②在该反应中,氧化剂是________________ ,氧化产物是_______________。
【答案】焊接钢轨(或冶炼难熔金属 ) 2Al+Fe2O3==== Al2O3+2Fe Al2O3+2NaOH==2NaAlO2+H2O HClO 保护FeSO4不被空气中的氧气氧化 2Mg+CO2![]() 2MgO+C
2MgO+C  N2 CO
N2 CO
【解析】
试题(1)铝热法是一种利用铝的还原性获得高熔点金属单质的方法;如氧化铁与铝粉反应生成氧化铝和铁;氧化铝是两性氧化物与氢氧化钠溶液反应生成偏铝酸钠。(2)次氯酸具有漂白、消毒作用;亚铁离子易被氧化为铁离子;(3)镁能在二氧化碳中燃烧;
(4)氮化铝中氮元素化合价由0变为-3,碳元素化合价由0变为+2,据此回答;
解析:(1)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,铝热反应在工业生产中的重要用途之一是冶炼难熔金属;如氧化铁与铝粉反应生成氧化铝和铁,反应方程式是2Al+Fe2O3==== Al2O3+2Fe;氧化铝是两性氧化物与氢氧化钠溶液反应生成偏铝酸钠,反应方程式是Al2O3+2NaOH==2NaAlO2+H2O。(2)次氯酸具有漂白、消毒作用;亚铁离子易被氧化为铁离子,所以层糖衣的作用是保护FeSO4不被空气中的氧气氧化;(3)镁能在二氧化碳中燃烧,方程式是2Mg+CO2![]() 2MgO+C ;
2MgO+C ;
(4)氮化铝中氮元素化合价由0变为-3,碳元素化合价由0变为+2;
①该反应中电子转移的方向和数目 ;
;
②在该反应中,氮气中氮元素化合价由0变为-3,氧化剂是N2 ,碳元素化合价由0变为+2,氧化产物是CO
点睛 :所含元素化合价升高的反应物是还原剂,化合价升高所得的产物是氧化产物;所含元素化合价降低的反应物是氧化剂,化合价降低所得的产物是还原产物。

 名校课堂系列答案
名校课堂系列答案【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
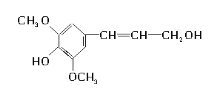
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:

①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。