题目内容
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。


(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。


(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。
(1)HC2O4+ H++C2O42—
H++C2O42—
(2)c(Na+)>c(C2O42—)>c(OH-)>c(HC2O4+)>c(H+)
(3)5 2 16 10 2 8
(4)①0.005 ②4×10-3 ③10-2 64%
 H++C2O42—
H++C2O42—(2)c(Na+)>c(C2O42—)>c(OH-)>c(HC2O4+)>c(H+)
(3)5 2 16 10 2 8
(4)①0.005 ②4×10-3 ③10-2 64%
(1)草酸氢钠溶液显酸性表明它的电离程度大于水解程度,其电离方程式为HC2O4— H++C2O42—。
H++C2O42—。
(2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液恰好完全反应生成Na2C2O4,它水解使溶液呈碱性,则各种离子浓度大小关系为c(Na+)>c(C2O42—)>c(OH-)>c(HC2O4—)>c(H+)。
(3)C2O42—中碳元素的化合价从+3升为+4,MnO4—中锰元素的化合价从+7降为+2,根据化合价升降守恒、电荷守恒和质量守恒配平即得:5C2O42—+2MnO4—+16H+=10CO2↑+2Mn2++8H2O。
(4)①根据消耗的OH-与H+的物质的量之比为1:1,则被中和的H+的物质的量为0.25mol/L×0.020L=0.005mol。②根据KMnO4被还原后生成Mn2+,转移电子为0.10mol/L×0.016L×5=0.008mol,反应中碳元素的化合价从+3变为+4,可得碳原子总物质的量为0.008mol,则还原剂的物质的量为0.004mol。③设25mL该溶液中H2C2O4·2H2O的物质的量为x mol,KHC2O4的物质的量为y mol,则有:
解得x=0.001,y=0.003。
则KHC2O4的质量分数为 ×100%=64%。
×100%=64%。
 H++C2O42—。
H++C2O42—。(2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液恰好完全反应生成Na2C2O4,它水解使溶液呈碱性,则各种离子浓度大小关系为c(Na+)>c(C2O42—)>c(OH-)>c(HC2O4—)>c(H+)。
(3)C2O42—中碳元素的化合价从+3升为+4,MnO4—中锰元素的化合价从+7降为+2,根据化合价升降守恒、电荷守恒和质量守恒配平即得:5C2O42—+2MnO4—+16H+=10CO2↑+2Mn2++8H2O。
(4)①根据消耗的OH-与H+的物质的量之比为1:1,则被中和的H+的物质的量为0.25mol/L×0.020L=0.005mol。②根据KMnO4被还原后生成Mn2+,转移电子为0.10mol/L×0.016L×5=0.008mol,反应中碳元素的化合价从+3变为+4,可得碳原子总物质的量为0.008mol,则还原剂的物质的量为0.004mol。③设25mL该溶液中H2C2O4·2H2O的物质的量为x mol,KHC2O4的物质的量为y mol,则有:

解得x=0.001,y=0.003。
则KHC2O4的质量分数为
 ×100%=64%。
×100%=64%。
练习册系列答案
相关题目
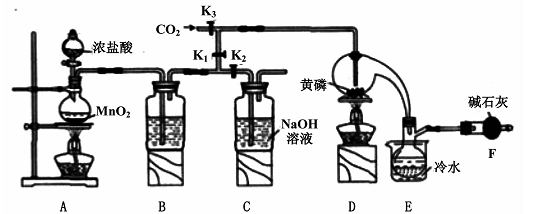

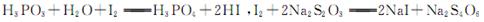 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
