题目内容
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
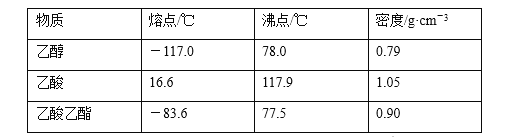
(1) 直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。CH4、CO、CH3OH都是重要的能源物质,等质量的上述气体充分燃烧,消耗O2最多的是_______ (填化学式)。
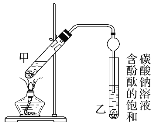
(2) 燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
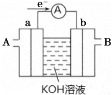
①使用时,空气从_________ 口通入(填“A”或“B”);
②假设使用的“燃料”是甲烷,a极的电极反应为:_________________ 。
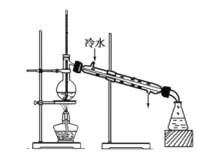
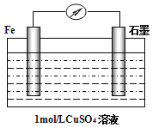
(3)某同学设计如图的原电池,则正极的电极反应式为:______________ ,当导线中有3.01×1023个电子流过,溶液质量变化为________ g。
【答案】CH4 B CH4 - 8e- + 10OH- = CO32- + 7H2O Cu2+ + 2e- = Cu 2
【解析】
(1)CH4、CO、CH3OH燃烧的方程式分别是:CH4+2O2![]() CO2+2H2O、2CO+O2
CO2+2H2O、2CO+O2![]() 2CO2、2CH3OH+3O2
2CO2、2CH3OH+3O2![]() 2CO2+4H2O,根据方程式,每克燃料所对应O2的质量分别是4g、0.57g、1.5g,故相同质量下甲烷消耗氧气最多;
2CO2+4H2O,根据方程式,每克燃料所对应O2的质量分别是4g、0.57g、1.5g,故相同质量下甲烷消耗氧气最多;
(2)①根据图中电子流向可判断a为负极,b为正极,燃料电池中正极需通入O2,故空气从B口通入;
②CH4在负极发生氧化反应,碱性环境中生成CO32-,故电极反应为:CH4 - 8e- + 10OH- = CO32- + 7H2O;
(3)由图可知,Fe为负极,石墨为正极,电解质为CuSO4,正极是Cu2+发生反应:Cu2++2e- = Cu,当导线中有3.01×1023个电子流过,即转移0.5mol电子,溶液中Cu2+转化为Cu析出64g/mol×0.25mol=16g,Fe转化为Fe2+进入溶液质量为56g/mol![]() 0.25mol=14g,故溶液质量减少16g-14g=2g。
0.25mol=14g,故溶液质量减少16g-14g=2g。

【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
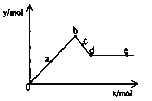
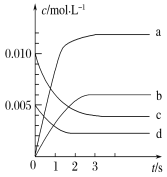
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(2)能说明该反应已达到平衡状态的是________(填字母,下同)。
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂