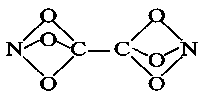
题目内容
下列有关粒子间的作用力,说法正确的是
| A.HCI溶于水时.H— Cl键会断裂 |
| B.H2O2分子中只有极性键 |
| C.NH3是以非极性键结合的分子 |
| D.MgCl2中既有离子键,又有共价键 |
A
解析

练习册系列答案
相关题目
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.以上说法都不正确。 |
常压下,苯的沸点低于甲苯,熔点却高于甲苯。苯的熔点更高的原因可能是
| A.苯具有芳香性 | B.苯中的化学键强度更强 |
| C.苯分子间作用力更小 | D.固态时苯分子排列更紧密 |
两个或多个同种含氧酸分子之间可以脱水形成相对分子质量更大的酸,如磷酸可形成H4P2O7或H5P3O10等。下列物质不属于硫酸脱水后形成的是( )
| A.H2S2O7 | B.H2S3O10 | C.H4S3O12 | D.H2S4O13 |
下列物质中,含有共价键的离子化合物是
| A.NH3 | B.HCl | C.NaOH | D.NaCl |
关于化学键的下列叙述中,正确的是
| A.离子化合物不可能含共价键 | B.共价化合物可能含离子键 |
| C.离子化合物中只含离子键 | D.共价化合物中不含离子键 |
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
| A.CO2 | B.H3O+ | C.CH4 | D.H2SO4 |
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲:
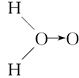 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________________________________________________________。