题目内容
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电于云均呈球形 |
Y | 原子的能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原于核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原于的围电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题:
(1)基态T2+的电子排布式为____________。
(2)Y.Z.R 的电负性由大到小的顺序为____________ (用元素符号表示)。
(3)YX4+的空间构型为____________,离子中Y原子的杂化轨道类型为____________ ,YX4+电子式为________。
(4)YX3的一种等电子体分子是______,YX3 的键角大于X2Z的键角的主要原因是________。
(5)T单质不溶于YX3溶液,也不溶于X2Z溶液,但能溶于它们的混合溶液,其主要原因是形成了稳定的[T(YX3)4]2+,1mol该阳离子中共含有______mol σ键。
(6)Z、T组成的晶胞结构如下图所示。已知Z、T原子的半径分别为apm、bpm,晶胞边长为cpm,则该晶胞中原子的空间利用率为________(用代数式表示)。

【答案】 1s22s22p63s23p63d9(或[Ar]3d9) O>N>Si 正四面体形 sp3 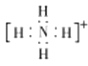 PH3(或AsH3等合理答案均可) NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小 16
PH3(或AsH3等合理答案均可) NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小 16 ![]()
【解析】本题主要考查原子结构和晶体结构及其计算。根据题意判断X、Y、Z、R、T分别是氢、氮、氧、硅、铜。
(1)基态T2+的电子排布式为1s22s22p63s23p63d9(或[Ar]3d9)。
(2)非金属性:O>N>Si,所以Y、Z、R的电负性由大到小的顺序为O>N>Si。
(3)YX4+的中心原子的价层电子对为4,其空间构型为正四面体形,离子中Y原子的杂化轨道类型为sp3,YX4+电子式为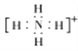 。
。
(4)YX3的一种等电子体分子是PH3(或AsH3等合理答案均可),YX3的键角大于X2Z的键角的主要原因是NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小。
(5)NH3中含有3个σ键,Cu2+与4个NH3分子之间存在4个σ键,[T(YX3)4]2+中共含有16个电子,所以1mol该阳离子中共含有16molσ键。
(6)晶胞含有4个Z原子、2个T原子,则该晶胞中原子的空间利用率为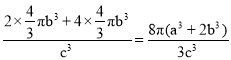 。
。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案



