题目内容
为配制某培养液,需要用含NaH2PO4和Na2HPO4(物质的量的比为3∶1)的混合液,每升混合液中含磷元素3.1g.现用4.0mol/L H3PO4溶液和固体NaOH配制2.0 L混合液,问需取该H3PO4多少毫升?NaOH固体多少克?
答案:
解析:
提示:
解析:
|
每升混合液中含磷的物质的量为: n(P)=n(NaH2PO4)+n(Na2HPO4)=n(H3PO4)= 故2.0L混合液需H3PO4溶液: 2.0L混合液中含磷0.2mol, n(H3PO4)=n(P)=n(NaH2PO4)+n(Na2HPO4)=0.2mol, 所以n(NaH2PO4)= n(Na2HPO4)= n(NaOH)=n(Na+)=0.15+0.05×2=0.25mol. NaOH固体的质量为:0.25mol×40g/mol=10g. 【巧解导析】以2.0L混合液中所含磷的物质的量确定所需4.0 mol/L H3PO4溶液的体积,以2.0L混合液中NaH2PO4和Na2HPO4的物质的量确定NaOH的物质的量. |
提示:
|
【巧解点悟】本题是利用守恒法进行计算,关键是先抓住磷原子守恒,计算H3PO4溶液体积,再抓住钠离子守恒求出NaOH质量.守恒法突出一个“简’、一个“巧”. |

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
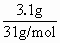 =0.1mol,
=0.1mol,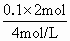 =0.05L=50mL.
=0.05L=50mL.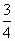 ×0.2=0.15mol,
×0.2=0.15mol,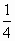 ×0.2=0.05mol.
×0.2=0.05mol.