题目内容
16.淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征.现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中的液体进行下列实验,能证明半透膜完好无损的是( )| A. | 加入BaCl2溶液产生白色沉淀 | B. | 加入碘水不变蓝 | ||
| C. | 加入BaCl2溶液没有白色沉淀产生 | D. | 加入碘水变蓝 |
分析 胶体粒子不能通过半透膜,而且其它小分子或离子可以通过半透膜,则证明半透膜完好无损即证明取烧杯中液体无淀粉,可用碘水检验.
解答 解:因淀粉是胶体,不能透过半透膜,则只要袋子不破损,淀粉就不会出来,加入碘水就不变蓝,故选B.
点评 本题考查了胶体性质,胶体的透性,根据实验考查了学生分析问题,解决问题的能力.

练习册系列答案
相关题目
7.室温下,对于0.1mol?L-1的氨水,下列有关说法正确的是( )
| A. | 氨水能导电,说明NH3是电解质 | |
| B. | 加水稀释,溶液中的c(OH-)增大 | |
| C. | 加入稀硫酸至溶液的pH=7,c(NH4+)=c(SO42-) | |
| D. | 向含有酚酞的氨水中加入少量NH4Cl晶体,溶液颜色变浅 |
4.下列说法正确的是( )
| A. | 在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 | |
| B. | 氧化剂在反应中被氧化,还原剂在反应中被还原 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 物质中若含有处于中间价态的元素,则该物质可能既具有氧化性又具有还原性 |
11.下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100 mL 0.5 mol/L MgCl2溶液 | B. | 200 mL 0.25 mol/L AlCl3溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 25 mL 0.5 mol/L HCl溶液 |
1.下列不能表明醋酸是弱电解质的是( )
| A. | 0.1mol/L的醋酸水溶液的pH值为3 | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使石蕊变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
8.某高聚物可表示为图所示,则下列叙述不正确的是( )
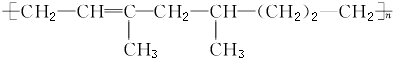
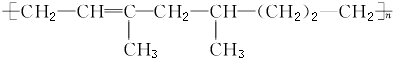
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
5.下列有机反应中,有一种反应类型与其他三种反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 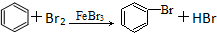 |
