题目内容
13.汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)═N2(g)+2CO2(g),请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-l
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-l
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-l
则2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ•mol-l.
(2)一定温度下,向体积为1L的密闭容器中充入一定量的NO和CO.在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8.
①则该反应的平衡常数K=270.若保持温度及容器体积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO,平衡将向右移动(填“向左”、“向右”或“不”).
②下列各种情况,可说明该反应已经达到平衡状态的是CD.
A.v生成(CO2)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图1所示:可能改变的条件是增大反应物的浓度,增大压强.

(3)有人提出可以用如图2所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式CO-2e-+4OH-=CO32-+2H2O.
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是B.
A.降低温度 B、增大压强同时加催化剂
C、升高温度同时充入N2 D、及时将CO2和N2从反应体系中移走.
分析 (1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-l②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-l③2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-l
用盖斯定律知:②×2-①-③得:2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ•mol-l.
(2)一定温度下体积为1L的密闭容器中,压强与混合气体的物质的量成正比.列出“三段式”:
2NO+2CO═N2 +2CO2
起始(mol):2a+0.2 2a+0.1 0 0
转化(mol):2a 2a a 2a
平衡(mol):0.2 0.1 a 2a
依题意得:0.2+0.1+a+2a=0.8(2a+0.2+2a+0.1)解得:a=0.3
①该反应的平衡常数K=$\frac{c({N}_{2}){C}^{2}(C{O}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$=$\frac{0.3×0.{6}^{2}}{0.{2}^{2}×0.{1}^{2}}$=270
保持温度及容器体积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO时,使容器内的压强增大,平衡向气体计量数小的方向移动,即向右移动.
②A.v生成(CO2)是向正反应方向,v消耗(CO)也是向正反应方向,不能达到平衡状态; B.由ρ(混合气体)=m(混合气体)/v知,密闭容器中m(混合气体)和v都不变,比值不变,即ρ(混合气体)不变,故密度不再改变不能达到平衡状态;
C.由M(混合气体)=m(混合气体)/n(混合气体),密闭容器中m(混合气体)不变,n(混合气体),向正反应方向移动时减小,向逆反应方向移动时增大,故平均相对分子质量不再改变,平衡不移动,能达到平衡状态;
D.NO、CO、N2、CO2的浓度不再变化是各物质的浓度保持不变,能达到平衡状态;
E.单位时间内生成2nmol碳氧双键即生成nmol的CO2,反应向正反应方向,同时消耗nmolN≡N
即消耗nmolN2反应向逆反应方向,但不与物质计量数成正比,故不能达到平衡状态.
选C,D;
③根据图象知,改变某一外界条件,平衡向正反应方向移动,可增大反应物的浓度,也可增大压强.3
(3)阳极发生是失电子的一极为CO,CO失电子后为CO2在KOH电解质溶液中最终生成CO32-,电极反应式为:CO-2e-+4OH-=CO32-+2H2O;
(4)提高该反应的速率可以增大压强或升高温度,提高NO的转化率应使平衡向正反应方向移动.A降低温度降低了反应的速率;B增大压强使平衡向正反应方向移动同时加催化剂提高该反应的速率;
C、升高温度提高该反应的速率,同时充入N2使反应向逆反应方向移动;
D、及时将CO2和N2从反应体系中移走压强降低,降低了反应的速率.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-l②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-l③2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-l
用盖斯定律知:②×2-①-③得:2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ•mol-l.
故答案为:-746.5;
(2)列出“三段式”:
2NO+2CO═N2 +2CO2
起始(mol):2a+0.2 2a+0.1 0 0
转化(mol):2a 2a a 2a
平衡(mol):0.2 0.1 a 2a
依题意得:0.2+0.1+a+2a=0.8(2a+0.2+2a+0.1)解得:a=0.3
①该反应的平衡常数K=$\frac{c({N}_{2}){C}^{2}(C{O}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$=$\frac{0.3×0.{6}^{2}}{0.{2}^{2}×0.{1}^{2}}$=270
故答案为:270
平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO时,使容器内的压强增大,平衡向气体计量数小的方向移动,即向右移动.
故答案为:向右
②A.v生成(CO2)是向正反应方向,v消耗(CO)也是向正反应方向,不能达到平衡状态;
B.由ρ(混合气体)=m(混合气体)/v知,密闭容器中m(混合气体)和v都不变,比值不变,即ρ(混合气体)不变,故密度不再改变不能达到平衡状态;
C.由M(混合气体)=m(混合气体)/n(混合气体),密闭容器中m(混合气体)不变,n(混合气体),向正反应方向移动时减小,向逆反应方向移动时增大,故平均相对分子质量不再改变,平衡不移动,能达到平衡状态;
D.NO、CO、N2、CO2的浓度不再变化是各物质的浓度保持不变,能达到平衡状态;
E.单位时间内生成2nmol碳氧双键即生成nmol的CO2,反应向正反应方向,同时消耗nmolN≡N
即消耗nmolN2反应向逆反应方向,但不与物质计量数成正比,故不能达到平衡状态.
故答案为:C,D
③根据图象知,改变某一外界条件,平衡向正反应方向移动,可增大反应物的浓度,也可增大压强.
故答案为:增大反应物的浓度,增大压强.
(3)阳极发生是失电子的一极为CO,CO失电子后为CO2在KOH电解质溶液中最终生成CO32-,电极反应式为:CO-2e-+4OH-=CO32-+2H2O;
故答案为:CO-2e-+4OH-=CO32-+2H2O
(4)提高该反应的速率可以增大压强或升高温度,提高NO的转化率应使平衡向正反应方向移动.A降低温度降低了反应的速率;B增大压强使平衡向正反应方向移动同时加催化剂提高该反应的速率;
C、升高温度提高该反应的速率,同时充入N2使反应向逆反应方向移动;
D、及时将CO2和N2从反应体系中移走压强降低,降低了反应的速率.
故答案为:B;
点评 考查用“三段式“进行化学平衡常数的计算;化学平衡状态的特征判断;电极反应考虑电解质溶液;注意物质CO2特殊的结构式.

| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
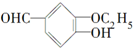 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )| A. | 该物质可以进行消去反应 | |
| B. | 该物质可以进行水解反应 | |
| C. | 1 mol该物质最多可与3 mol H2反应 | |
| D. | 该物质可以和Br2进行取代反应 |
 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
| A. | 烃的相对分子量均为奇数 | |
| B. | 硝基化合物的相对分子量均是偶数 | |
| C. | 烃及烃的含氧衍生物的相对分子量均为偶数 | |
| D. | 酚、醛、氨基酸、酯的相对分子量均为奇数 |
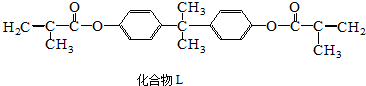
| A. | 1mol L分别与足量NaOH溶液和H2反应,最多可消耗4molNaOH和10molH2 | |
| B. | 有机酸M与油酸互为同系物,双酚A与苯酚互为同系物 | |
| C. | 与M含相同官能团的同分异构体还有2种 | |
| D. | 等物质的量的L、A和M 与足量浓溴水发生反应,消耗Br2的量之比为1:2:1 |
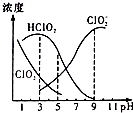 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )| A. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 使用该漂白剂的最佳pH为3.0 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
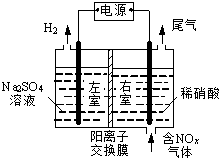 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).