题目内容
【题目】钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

(1)基态钛原子的价电子排布图为 ______________,其原子核外共有_______种运动状态不相同的电子, 金属钛晶胞如图1所示,为________ 堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,据此可知TiCl4形成的晶体类型为________。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2,化合物乙的沸点明显高于化合物甲,主要原因是______________,化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为______________。

(4)硫酸氧钛晶体中阳离子为链状聚合形状的离子,结构如图3所示,该阳离子Ti与O的原子数之比为___________________,其化学式为_________________。
(5)钙钛矿晶体的结构如图4所示,钛离子位于立方晶胞的角顶,被_______个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被_________个氧离子包围, 钙钛矿晶体的化学式为______________。
 。
。
【答案】 ![]() 22 六方最密 分子晶体 乙分子间形成氢键 O>N>C 1:1 TiO2+(或
22 六方最密 分子晶体 乙分子间形成氢键 O>N>C 1:1 TiO2+(或![]() ) 6 12 CaTiO3
) 6 12 CaTiO3
【解析】试题分析:由流程可知,钙钛矿经硫酸浸取后过滤得到硫酸氧钛溶液,该溶液加水后加热,硫酸氧钛水解得到钛酸沉淀,过滤得到钛酸,钛酸经焙烧后得到二氧化钛,二氧化钛与C和Cl2一起在高温下反应生成四氯化钛,最后四氯化钛在高温下用镁还原得到钛,氩气作保护气。
(1)钛是22号元素,基态钛原子的价电子排布式为3d24s2,其价电子排布图为![]() ,其原子核外共有22种运动状态不相同的电子。 由金属钛晶胞结构示意图可知,其为六方最密堆积。
,其原子核外共有22种运动状态不相同的电子。 由金属钛晶胞结构示意图可知,其为六方最密堆积。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,其熔、沸点较低,故TiCl4形成的晶体类型为分子晶体。
(3)化合物乙的沸点明显高于化合物甲,主要原因是乙分子间形成氢键,而甲分子间不能形成氢键,化合物乙中采取sp3杂化的原子有C、O、N,C、O、N的电负性由大到小的顺序为O>N>C。
(4)硫酸氧钛晶体中阳离子为链状聚合形状的离子,由其结构示意图可知,每个O与2个Ti成键、每个Ti与2个O成键,故该阳离子中Ti与O的原子数之比为1:1,因为Ti显+4价、O显-2价,故其化学式为TiO2+(或![]() )。
)。
(5)由钙钛矿晶体的结构示意图可知,钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,晶胞的12条棱边的中心都有1个O离子,故钙离子被12个氧离子包围。 由均摊法可知,氧原子数为12×![]() =3,钛原子数为8×
=3,钛原子数为8×![]() =1,钙离子数为1,故该晶胞中钙钛矿晶体的化学式为CaTiO3。
=1,钙离子数为1,故该晶胞中钙钛矿晶体的化学式为CaTiO3。

【题目】以下是25℃时几种难溶电解质的溶度极数值:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.0×10-12 | 1.0×10-20 | 1.0×10-16 | 1.0×10-38 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为___________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式__________________________________。
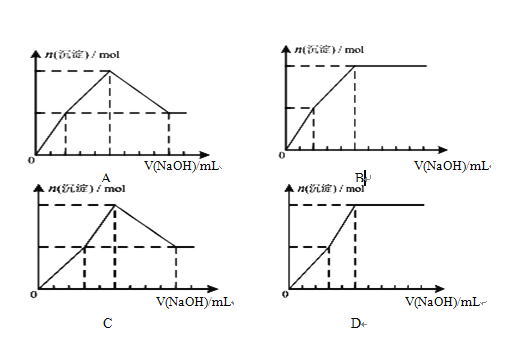
(4) 向浓度均为0.1mol/L-1的Fe(NO3)3和Cu(NO3)2混合溶液中,逐滴加入NaOH.下列示意图表示生成沉淀的总物质的量与加入NaOH的体积的关系,合理的是(____)
(5)若将某MgCl2、FeCl3均为0.1 mol·L-1混合溶液中的pH用MgO调整至pH=4,则溶液中![]() 比值约为______________________。
比值约为______________________。


