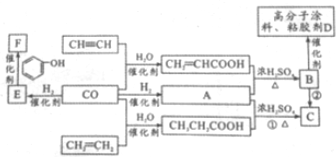
题目内容
7.下列说法正确的是( )| A. | 按系统命名法,化合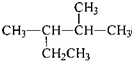 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
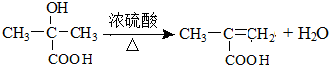
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: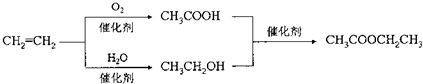 |
分析 A、烷烃的命名应选取最长碳链为主链,最长的主链含5个C;
B、同系物中官能团的种类及数目相同;
C、乙炔的分子式为C2H2,乙醛的分子式为C2H40,据分子式判断耗氧量;
D、以乙烯为原料制备乙酸乙酯,需要将乙烯氧化为乙酸,乙烯与水加成生成乙醇,再通过酯化反应生成乙酸乙酯.
解答 解:A、 的名称为2,3-二甲基戊烷,故A错误;
的名称为2,3-二甲基戊烷,故A错误;
B、甘油是丙三醇,分子中含3个羟基,与甲醇、乙醇不是同系物,故B错误;
C、1mol乙炔燃烧消耗2.5mol氧气,1mol乙醛燃烧也是消耗2.5mol氧气,等物质的量的乙炔、乙醛,完全燃烧时的耗氧量相等,故C错误;
D、以乙烯为原料制备乙酸乙酯,需要将乙烯氧化为乙酸,乙烯与水加成生成乙醇,再通过酯化反应生成乙酸乙酯,即合成路线可为 故D正确;
故D正确;
故选D.
点评 本题考查了烷烃的命名、同系物的判断、有机物燃烧耗氧量的计算、有机合成,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
10.原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
请回答下列问题:
(1)B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl(填元素符号);
(2)B的氢化物中心原子采取sp3杂化,空间构型是三角锥形,是极性分子(填“极性”或“非极性”);
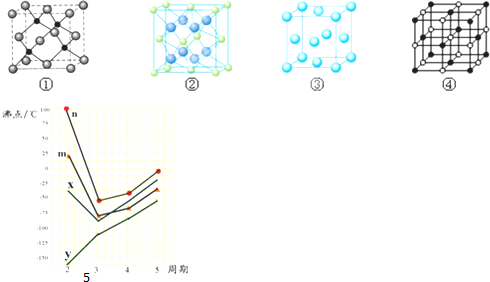
(3)F2+与NH3形成配离子的化学式为[Cu(NH3)4]2+,F单质晶体晶胞是下图的③(填①、②、③或④);
(4)A,E两种元素形成晶体晶胞是图中的②(填①、②、③或④),A离子的配位数是4;若晶胞边长为apm(皮米),则A,E两种粒子的最近距离可表示为$\frac{\sqrt{3}}{4}$apm
(5)图5四条折线分别表示Ⅳ族、VA族、ⅥA族、VⅡA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线n(填n,m,x或y)
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl(填元素符号);
(2)B的氢化物中心原子采取sp3杂化,空间构型是三角锥形,是极性分子(填“极性”或“非极性”);
(3)F2+与NH3形成配离子的化学式为[Cu(NH3)4]2+,F单质晶体晶胞是下图的③(填①、②、③或④);
(4)A,E两种元素形成晶体晶胞是图中的②(填①、②、③或④),A离子的配位数是4;若晶胞边长为apm(皮米),则A,E两种粒子的最近距离可表示为$\frac{\sqrt{3}}{4}$apm
(5)图5四条折线分别表示Ⅳ族、VA族、ⅥA族、VⅡA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线n(填n,m,x或y)

2.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数均为K=2 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
12.二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3为原料合成尿素.经研究发现该反应过程为:
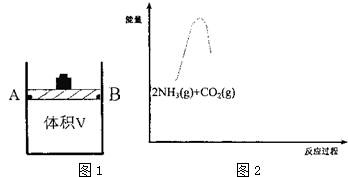
①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
①T1℃下,lOmin内NH3的平均反应速率为0.04mol•L-1•min-1.
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.

①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.
19.短周期元素X、Y、Z、W,它们的原子序数依次增大.X与Z同主族,且原子序数之和为20.Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个.下列叙述正确的是( )
| A. | 原子半径Z>W>Y>X | |
| B. | 气态氢化物的稳定性Z>W | |
| C. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| D. | X的气态氢化物与足量W单质在光照条件下反应所得生成物均为气体 |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
 ,回答问题:
,回答问题: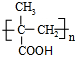 .
. .
.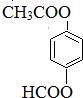 (只写一种).
(只写一种).