题目内容
4.实验测得一氧化碳与氧气混合气体的密度是氢气的14.5倍,则其中氧气的质量分数为( )| A. | 25.0% | B. | 27.6% | C. | 72.4% | D. | 75.0% |
分析 相同条件下,不同气体的密度之比等于其摩尔质量之比,据此计算混合气体的平均平均摩尔质量,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算其物质的量之比,再根据m=nM计算其质量之比,进而计算氧气质量分数.
解答 解:一氧化碳与氧气混合气体的密度是氢气的14.5倍,则混合气体平均摩尔质量为2g/mol×14.5=29g/mol,设混合气体中CO的物质的量为xmol、氧气的物质的量为ymol,则:$\frac{28x+32y}{x+y}$=29,解得x:y=3:1,则一氧化碳、氧气的质量之比=3mol×28g/mol:1mol×32g/mol=21:8,故氧气的质量分数为$\frac{8}{8+21}$×100%=27.6%,故选B.
点评 本题考查混合物的计算,侧重于学生的分析计算能力的考查,注意相对密度的运用,难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应2Al+3Cu2+=2Al3++3Cu;化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示:
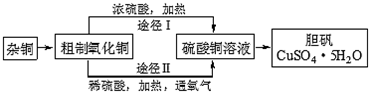
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放在b上,不能直接放在桌面上.实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的氯化铜溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu;化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放在b上,不能直接放在桌面上.实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
15.化学家于1995年合成了一种分子式为C200H200的含有多个碳碳叁键的链烃,其分子中含有碳碳叁键数目最多可以是( )
| A. | 49 | B. | 50 | C. | 51 | D. | 无法确定 |
12.下列反应中,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O | D. |  +Br$\stackrel{FeBr_{3}}{→}$ +Br$\stackrel{FeBr_{3}}{→}$ +HBr +HBr |
19.下列除去杂质的方法正确的是( )
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 二氧化碳 | 一氧化碳 | 点燃 |
| B | 铁粉 | 铜粉 | 过量稀硫酸溶液、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | 一氧化碳 | 二氧化碳 | 通过足量灼热的氧化铜 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
9.若某原子的摩尔质量是M g•mol-1,则一个该原子的实际质量是( )
| A. | M g | B. | $\frac{1}{M}$ g | C. | $\frac{M}{6.02×1{0}^{23}}$ g | D. | $\frac{6.02×1{0}^{23}}{M}$g |
 A~F是初中化学常见的六种物质,它们之间的关系如图所示.“→”表示物质间的转化关系,“--”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).A可以与酸、碱、盐三类物质发生反应,D是食盐的主要成分,C和F都是无色气体,反应①和②都有白色沉淀生成.
A~F是初中化学常见的六种物质,它们之间的关系如图所示.“→”表示物质间的转化关系,“--”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).A可以与酸、碱、盐三类物质发生反应,D是食盐的主要成分,C和F都是无色气体,反应①和②都有白色沉淀生成. 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题: