题目内容
实验编号 相关数据 |
① | ② | ③ | ④ | ⑤ |
| c(H+)/mol?L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
| c(BrO3-)/mol?L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
| c(Br-)/mol?L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
| v/mol?L-1?s-1 | 2.4×10-8 | 4.8×10-8 | 1.2×10-8 | 4.8×10-8 | v1 |
| A.若温度升高到40℃,则反应速率增大 |
| B.实验②、④,探究的是c(BrO3-)对反应速率的影响 |
| C.若该反应速率方程为v=k ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=2 |
| D.实验⑤中,v1=4.8×10-8mol?L-1?s-1 |
B、实验②、④中,c(Br-)也不相同,故B错误;
C、②、③中,氢离子浓度增大1倍,速率增大到原来的4倍,故c=2,故C正确;
D、③、⑤中,c(Br-)和c(BrO3-)浓度关系,⑤中的二者浓度都比③中的增大一倍,速率增大4倍,v1=4.8×10-8mol?L-1?s-1,故D正确;
故选B.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案某学习小组为了探究 BrO3-+5Br-+6H+=3Br2+3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
|
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)酸性条件下高锰酸钾溶液分解的离子方程式 。
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
______MnO4— +______C2O42—+______H+=______Mn2++______CO2↑+____________
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) |
高锰酸钾溶液紫色褪去的时间 |
|
先滴入第1滴 |
1min |
|
褪色后再滴入第2滴 |
15s |
|
褪色后再滴入第3滴 |
3s |
|
褪色后再滴入第4滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因 。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度。他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
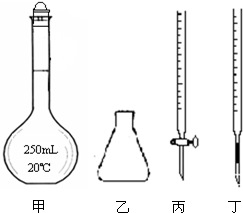
①高锰酸钾溶液应装在 (填下图中的仪器编号)。
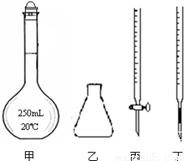
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是 。
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是 。
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为 。

 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.