题目内容
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从色变为色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察;
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填偏高、偏低或无影响);
(4)步骤②缺少的操作是;
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL;
(6)根据如表数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
请计算待测烧碱溶液的浓度为mol/L.
【答案】
(1)红;无
(2)B
(3)待测溶液润洗锥形瓶;偏高
(4)用标准液润洗滴定管
(5)22.60
(6)0.08
【解析】解:(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,并且30S内不变色;所以答案是:红;无;(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,以判定终点;所以答案是:B;(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据根据c(待测)= ![]() 分析,可知c(待测)偏大;所以答案是:待测溶液润洗锥形瓶;偏高;(4)根据酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗,以防被稀释;所以答案是:用标准液润洗滴定管;(5)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60mL;所以答案是:22.60;(6)两次消耗的盐酸标准液的体积为19.90mL,20.00mL,均有效,标准盐酸溶液的平均体积为19.95mL, HCl~NaOH
分析,可知c(待测)偏大;所以答案是:待测溶液润洗锥形瓶;偏高;(4)根据酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗,以防被稀释;所以答案是:用标准液润洗滴定管;(5)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60mL;所以答案是:22.60;(6)两次消耗的盐酸标准液的体积为19.90mL,20.00mL,均有效,标准盐酸溶液的平均体积为19.95mL, HCl~NaOH
1 1
0.1000molL﹣1×19.95mL c(NaOH)×25.00mL
解得:c(NaOH)=0.08mol/L;
所以答案是:0.08.
【考点精析】掌握酸碱中和滴定是解答本题的根本,需要知道中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
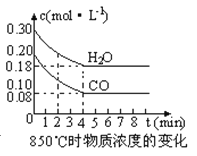
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
