题目内容
9.下列溶液中氯离子浓度与20mL 1mol•L-1氯化铝溶液中的氯离子浓度相等的是( )| A. | 60 mL 1 mol•L-1的氯化钠溶液 | B. | 30 mL 2 mol•L-1的氯化铵溶液 | ||
| C. | 60 mL 3 mol•L-1的氯化钾溶液 | D. | 30 mL 1 mol•L-1的氯化铁溶液 |
分析 电解质离子的物质的量浓度=溶质的物质的量浓度×溶质化学式中含有离子的个数,与溶液的体积无关.
解答 解:20mL 1mol•L-1的AlCl3溶液中氯离子的物质的量浓度为1mol•L-1×3=3mol•L-1.
A.60mL 1mol•L-1的KCl溶液中氯离子的物质的量浓度为1mol•L-1×1=1mol•L-1,故A错误;
B.30mL 2mol•L-1的NH4Cl溶液中氯离子的物质的量浓度为2mol•L-1×1=2mol•L-1,故B错误;
C.60mL 1mol•L-1的KCl溶液中氯离子的物质的量浓度为1mol•L-1×1=1mol•L-1,故C错误;
D.30mL 1mol•L-1的FeCl3溶液中氯离子的物质的量浓度为1mol•L-1×3=3mol•L-1,故D正确;
故选:D.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.当CH3COOH?CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是( )
| A. | CH3COONa | B. | NH3•H2O | C. | HCl | D. | H2O |
20.针对如图所示乙醇分子结构,下述关于乙醇在各种反应中化学键断裂情况的说法不正确的是( )


| A. | 与醋酸、浓硫酸共热时,②键断裂 | B. | 与金属钠反应时,①键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②⑤键断裂 | D. | 在银催化下与O2反应时,①③键断裂 |
17.物质的量浓度相同(0.1mol•L-1)的弱酸HX与NaX溶液等体积混合后,溶液中粒子浓度关系错误的是( )
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | c(HX)+c(X-)=2c(Na+) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
4.下列分散系不能发生丁达尔现象的是( )
| A. | 豆浆 | B. | 牛奶 | C. | 食盐溶液 | D. | 烟、云、雾 |
1.下列叙述正确的是( )
| A. | 分散质直径介于1 nm-100 nm之间的分散系称为胶体 | |
| B. | Fe(OH)3难溶于水,因此不可能均匀分散在水里形成稳定的红褐色的液体 | |
| C. | 氢氧化铁胶体粒子在电泳实验中向阴极移动,是因为氢氧化铁胶体粒子带负电 | |
| D. | 胶体粒子是很多分子的集合体,因此都很不稳定,容易聚沉 |
18.某同学按下列步骤配制500mL 0.2mol•L-1Na2SO4溶液,请回答有关问题.
(1)上述实验中使用容量瓶前应检查容量瓶是否漏液.
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需重新配制.
(4)配制Na2SO4溶液时,下列操作情况会使结果偏高的是C.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为14.2克 |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平和药匙 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 转移过程中用玻棒进行引流 |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至凹液面与刻度线相切 |
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需重新配制.
(4)配制Na2SO4溶液时,下列操作情况会使结果偏高的是C.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
2.硫代硫酸钠俗称保险粉,又名“大苏打”.可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂.
Ⅰ.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
下列有关说法正确的是AD
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.
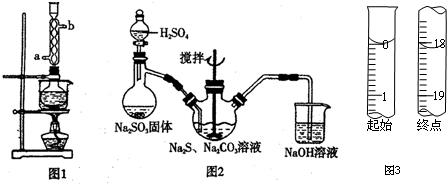
(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
Ⅰ.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).