题目内容
下列叙述正确的是
- A.氯化钠溶液能导电,所以氯化钠溶液是电解质
- B.氯化氢水溶液能导电,所以氯化氢是电解质
- C.二氧化碳溶于水能导电,所以二氧化碳是电解质
- D.金属铜能导电,所以铜是电解质
B
分析:在水溶液里或熔融状态下能导电的化合物是电解质,注意电解质和非电解质首先必须是化合物,根据概念分析.
解答:A.虽然氯化钠溶液中有自由移动的离子,能导电,但氯化钠溶液是混合物不是化合物,故A错误;
B.氯化氢水溶液能导电,氯化氢是电解质,故B正确;
C.二氧化碳的水溶液能导电,但电离出自由移动离子的是碳酸不是二氧化碳,所以二氧化碳不是电解质,故C错误;
D.铜丝是单质,所以既不是电解质也不是非电解质,故D错误.
故选B.
点评:本题考查了电解质、非电解质的判断,难度不大,注意无论是电解质还是非电解质都必须是化合物,能导电的物质不一定是电解质,如铜丝,电解质不一定导电,如氯化钠晶体.
分析:在水溶液里或熔融状态下能导电的化合物是电解质,注意电解质和非电解质首先必须是化合物,根据概念分析.
解答:A.虽然氯化钠溶液中有自由移动的离子,能导电,但氯化钠溶液是混合物不是化合物,故A错误;
B.氯化氢水溶液能导电,氯化氢是电解质,故B正确;
C.二氧化碳的水溶液能导电,但电离出自由移动离子的是碳酸不是二氧化碳,所以二氧化碳不是电解质,故C错误;
D.铜丝是单质,所以既不是电解质也不是非电解质,故D错误.
故选B.
点评:本题考查了电解质、非电解质的判断,难度不大,注意无论是电解质还是非电解质都必须是化合物,能导电的物质不一定是电解质,如铜丝,电解质不一定导电,如氯化钠晶体.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
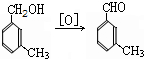
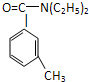 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH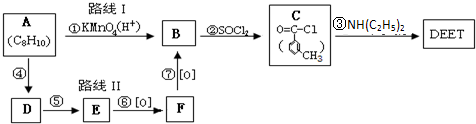
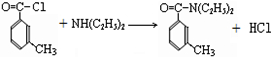
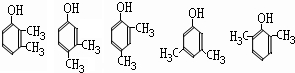 (任写2种)
(任写2种)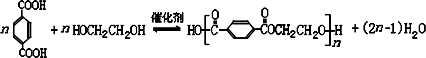
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.