题目内容
一氧化碳是一种用途广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:
Ni(s)+4CO
Ni(CO)4(g),则该反应的△H .(选填“>”或“<”).
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol -1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol -1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol -1
请写出CO除SO2的热化学方程式 .
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0.如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 .
(4)如图l是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
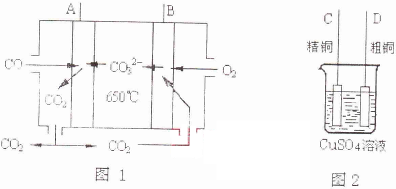
回答下列问题:
①写出A极发生的电极反应式 .
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连.
③当消耗标准状况下2.24L CO时,C电极的质量变化为 .
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:
Ni(s)+4CO
| ||
| 180-200℃ |
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol -1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol -1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol -1
请写出CO除SO2的热化学方程式
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0.如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
(4)如图l是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.

回答下列问题:
①写出A极发生的电极反应式
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
③当消耗标准状况下2.24L CO时,C电极的质量变化为
考点:反应热和焓变,热化学方程式,化学电源新型电池,化学平衡的计算
专题:基本概念与基本理论
分析:(1)大多数的化合反应为放热反应,放热反应的△H<0;
(2)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(3)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算;
(4)①根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;
②根据A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
③根据电子得失守恒以及精铜中铜离子得到电子来计算.
(2)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(3)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算;
(4)①根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;
②根据A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
③根据电子得失守恒以及精铜中铜离子得到电子来计算.
解答:
解:(1)反应Ni(s)+4CO(g)
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ?mol-1,故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ?mol-1;
(3)设参加反应的CO的浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=
=
,x=0.225,所以CO的转化率α(CO)=
×100%=75%,氢气反应速率v(H2)=
=0.045mol/(L?min),
故答案为:75%;0.045mol/(L?min);
(4)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D
③当消耗标准状况下1.12L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为
×2=0.1mol,精铜电极电极反应式:Cu2++2e-=Cu,由电子得失守恒可知Cu2+的物质的量为
=0.1mol,精铜电极的质量增加的质量为:0.1mol×64g/mol=6.4g,
故答案:增加6.4g.
| 50-80℃ |
| 180-200℃ |
(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ?mol-1,故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ?mol-1;
(3)设参加反应的CO的浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=
| [CO2]?[H2] |
| [CO[?[H2O] |
| x2 |
| (0.30-x)2 |
| 0.225 |
| 0.30 |
| 0.225mol/L |
| 5min |
故答案为:75%;0.045mol/(L?min);
(4)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D
③当消耗标准状况下1.12L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为
| 2.24L |
| 22.4L/mol |
| 0.2mol |
| 2 |
故答案:增加6.4g.
点评:本题考查了化学平衡常数的求算、电解质原理、原电池原理、氧化还原反应,综合性强,难度较大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列关于有机物的叙述正确的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 |
| C、油脂和纤维素都是能发生水解反应的高分子化合物 |
| D、甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
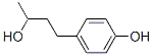 最近我国质检总局通报,日本佳丽宝公司生产的化妆品使用后皮肤会出现白斑,其中的有害成分为杜鹃醇(结构如图),有关杜鹃醇的说法不正确的是( )
最近我国质检总局通报,日本佳丽宝公司生产的化妆品使用后皮肤会出现白斑,其中的有害成分为杜鹃醇(结构如图),有关杜鹃醇的说法不正确的是( )| A、分子式为:C10H14O2 |
| B、水溶液酸性一定比碳酸强 |
| C、能与FeCl3溶液发生显色反应 |
| D、最多可与含3molBr2的溴水反应 |
室温下,下列变化后的溶液pH小于8的是( )
| A、pH=10的氨水稀释100倍 |
| B、pH=11的NaOH溶液与pH=5的盐酸等体积混合 |
| C、pH=8的NaOH溶液与pH=8的氨水等体积混合 |
| D、pH=4的醋酸和pH=10的NaOH溶液等体积混合 |