题目内容
铜与浓硝酸发生反应的化学方程式是____________________________________,若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生5.6L气体(标况下),在该反应中,转移电子的物质的量是_______________mol,则被还原的硝酸为__________________mol,起酸性作用的硝酸为__________________mol,共消耗硝酸__________________mol。
Cu + 4 HNO3(浓)= Cu(NO3)2+ 2NO2↑ + 2H2O;0.4;0.25;0.4;0.65

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验现象、解释与结论均正确的是( )
|
下列说法正确的是( )
| A、铝是金属,与强碱不能发生反应 | B、Na、Mg、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | C、将混有少量SO2的二氧化碳气体通入饱和NaHCO3溶液,可达到除杂的目的 | D、过量的铜与浓硝酸反应,生成的气体只有NO2 |
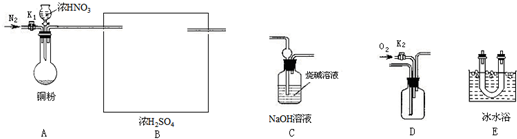
 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示: