��Ŀ����
����Ŀ������ֲ���纣���������к��д����ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ���������ͼ��
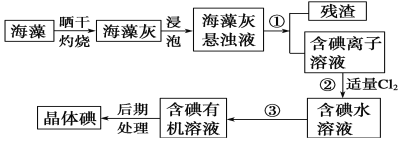
��1��ʵ���ұ��պ�������Ҫ���������е�________________(�����)��
a���Թ�b���ձ�c������d��������e�������ż�f���ƾ���
��2��ָ����ȡ��Ĺ������йص�ʵ������۵�������________________��������Ҫ������________________��
��3����ȡ��Ĺ����У���ѡ����л��Լ���________________
A���ױ����ƾ� B�����Ȼ�̼����C�����͡����� D�����͡�����
��4���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������뾭������ָ��ʵ��װ��ͼ�еĴ���֮����
��________________��
��________________��
��________________��
��5�����������������ʱ��ʹ��ˮԡ���ȵ�ԭ����________________�����̬����________________�����������ƣ���ۼ���
���𰸡�c��d��e��f ��ȡ��Һ ��Һ©�� B �¶ȼƵ�ˮ����Ӧ��λ��������ƿ��֧�ܿڴ� ���ձ�����ʱӦ��ʹ��ʯ���� �����ܵ�ˮ������Ӧ�����½��ϳ� ���Ⱦ��ȣ������¶� ������ƿ
��������
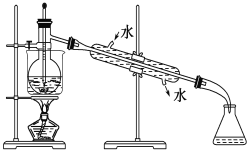
��1��ʵ���ұ��պ����������н��У�����Ҫc��������d�������ǡ�e�������żܡ�f���ƾ��ƣ�
����c��d��e��f��
��2��ʵ��������ǰѵ��ˮ��Һ��ת�Ƴ����Ĺ��̣��������ȡ����Һ���õ�����л���Һ��������Ҫ�ڷ�Һ©���н��У�
��Ϊ����ȡ��Һ����Һ©����
��3��A���ƾ���ˮ���ܣ���������ȡ����A����
B�����Ȼ�̼����������ȡ��������B��ȷ��
C��������ˮ���ܣ���������ȡ����C����
D��������ˮ���ܣ���������ȡ����D����
����B��
��4��������ʱ��ȷ��װ�ò���ͼ�е�3��������ͼ֪����3������ֱ����¶ȼƵ�λ�ó���������ʱû�и���ʯ�������ȡ�����ˮ���������
��Ϊ���¶ȼƵ�ˮ����Ӧ��λ��������ƿ��֧�ܿڴ������ձ�����ʱӦ��ʹ��ʯ�����������ܵ�ˮ������Ӧ�����½��ϳ���
��5��ʹ��ˮԡ���ȵ�ԭ�������Ⱦ��ȣ������¶ȣ��ɱ������������Ϊ��ȡ���۷е�ϵ�����������̬���ռ���������ƿ��
��Ϊ�����Ⱦ��ȣ������¶ȣ�������ƿ��

����Ŀ������ʵ�������ͼ����Ϣ���ܳ��˵����Ӧ�Ļ�ѧ��Ӧ�Ƿ��ȷ�Ӧ����
A | B | C | D | |
ͼʾ |
|
|
|
|
��� ��Ϣ | �¶ȼƵ�ˮ������������ | ��Ӧ������������������������ | ��Ӧ��ʼ�״�Һ������Ҵ�Һ�� | ��Ӧ��ʼ����Ͳ���������ƶ� |
A.AB.BC.CD.D