题目内容
在2L的密闭容器内充入5mol A和2.5mol B使之发生反应:3A(g)+B(g)?C(g)+2D(g),经过一段时间后反应达到平衡,经5min测定C的平均反应速率为0.1mol?L-1?min-1.则下列叙述中正确的是( )
| A、恢复至原温度,容器内压强增大 |
| B、A的平均反应速率为0.1 mol?L-1?min-1 |
| C、达到平衡时,B比A的转化率小 |
| D、B的平衡浓度为0.25 mol?L-1 |
考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算分析,经5min测定C的平均反应速率为0.1mol?L-1?min-1,则生成C物质的量=2L×5min×0.1mol?L-1?min-1 =1mol;
3A(g)+B(g)?C(g)+2D(g),
起始量(mol) 5 2.5 0 0
变化量(mol) 3 1 1 2
平衡量(mol) 2 1.5 1 2
A、反应是气体体积减小的反应;
B、依据V=
分析计算;
C、转化率=
×100%;
D、依据c=
计算
3A(g)+B(g)?C(g)+2D(g),
起始量(mol) 5 2.5 0 0
变化量(mol) 3 1 1 2
平衡量(mol) 2 1.5 1 2
A、反应是气体体积减小的反应;
B、依据V=
| △c |
| △t |
C、转化率=
| 消耗量 |
| 起始量 |
D、依据c=
| n |
| V |
解答:
解:依据化学平衡三段式列式计算分析,经5min测定C的平均反应速率为0.1mol?L-1?min-1,则生成C物质的量=2L×5min×0.1mol?L-1?min-1 =1mol;
3A(g)+B(g)?C(g)+2D(g),
起始量(mol) 5 2.5 0 0
变化量(mol) 3 1 1 2
平衡量(mol) 2 1.5 1 2
A、反应是气体体积减小的反应,随反应进行压强减小,故A错误;
B、A的平均反应速率V=
=
=0.3mol/L?min,故B错误;
C、转化率=
×100%,A转化率=
×100%=60%,B转化率=
×100%=40%,故C正确;
D、依据c=
计算,B的平衡浓度=
=0.75 mol?L-1,故D错误;
故选C.
3A(g)+B(g)?C(g)+2D(g),
起始量(mol) 5 2.5 0 0
变化量(mol) 3 1 1 2
平衡量(mol) 2 1.5 1 2
A、反应是气体体积减小的反应,随反应进行压强减小,故A错误;
B、A的平均反应速率V=
| △c |
| △t |
| ||
| 5min |
C、转化率=
| 消耗量 |
| 起始量 |
| 3 |
| 5 |
| 1 |
| 2.5 |
D、依据c=
| n |
| V |
| 1.5mol |
| 2L |
故选C.
点评:本题考查了化学平衡三段式计算应用,主要反应速率、转化率,浓度计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
科学家经研究证实光可诱发下列化学变化:

这一事实可解释人眼的夜视功能.有关X、Y的叙述中错误的是( )

这一事实可解释人眼的夜视功能.有关X、Y的叙述中错误的是( )
| A、X和Y不互为手性异构 |
| B、X和Y的所有原子都可能处于同一平面内 |
| C、一定条件下X和Y都可与7molH2加成反应 |
| D、X和Y都易溶于水 |
下列各组物质反应后,滴入KSCN溶液一定显红色的是( )
| A、生了锈的铁块放入稀H2SO4中 |
| B、FeCl3、CuCl2的混合溶液中加入过量的铁粉 |
| C、FeO放入稀HNO3中 |
| D、Fe放入HNO3溶液中 |
 如图是a、b两种固体物质的溶解度曲线.下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线.下列说法中正确的是( )| A、a物质的溶解度受温度变化的影响较小,b物质的溶解度受温度变化的影响较大 |
| B、t℃时,等质量的a、b饱和溶液中含有相同质量的溶质 |
| C、当温度大于t℃时,a溶液一定比b溶液浓 |
| D、a中含有少量b时,用冷却热饱和溶液的方法提纯a |
下列括号中的物质是除去杂质所用的试剂,其中错误的是( )
| A、NaCl溶液中混有Na2CO3(盐酸) |
| B、NaOH溶液中含少量Na2CO3(澄清石灰水) |
| C、CO2气体中含有少量HCl(浓碱溶液) |
| D、NaCl溶液中含有少量Na2SO4(氯化钡溶液) |
家用消毒液发生器是化学知识在日常生活中的“创新”应用.该发生器利用常见的精盐和自来水为反应物.通电时,发生器内电解槽里的极板上产生大量水泡.切断电源后所得的消毒液有强烈的杀菌能力,且对人体无害.溶液中发生的主要的反应为
2NaCl+2H2O=2NaOH+H2+Cl2 2NaOH+Cl2=NaCl+NaClO+H2O则所得消毒液的有效成分是( )
2NaCl+2H2O=2NaOH+H2+Cl2 2NaOH+Cl2=NaCl+NaClO+H2O则所得消毒液的有效成分是( )
| A、NaCl |
| B、Cl2 |
| C、NaClO |
| D、HClO |
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、含T的盐溶液一定显酸性 |
| B、最高价氧化物对应水化物的酸性:Q<W |
| C、原子半径:T>Q>R |
| D、最简单气态氢化物的热稳定性:R>Q |
下列说法正确的是( )
| A、摩尔是用于描述微观粒子的物理量 |
| B、0.012kg12C所含的原子数精确值是6.02×1023 |
| C、1mol H2的体积为22.4L |
| D、1molH2SO4的质量是98g |
正硼酸(H3BO3)是一种片层状结构白色晶体,受热易分解.层内的 H3BO3分子通过氢键相连(如图所示),则下列有关说法中正确的是( )
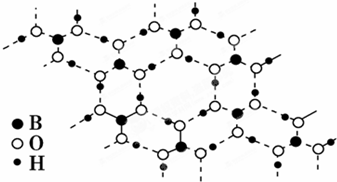

| A、正硼酸晶体属于原子晶体 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、1 mol H3BO3晶体中含有3 mol氢键 |
| D、分子中硼原子最外层为8电子稳定结构 |