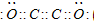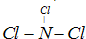题目内容
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)
| 阳离子 | H+ 、 Na+、 Al3+、 Ag+、 Ba2+ |
| 阴离子 | OH—、Cl—、CO32— 、NO3—、SO42— |
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②A溶液与E溶液反应既有沉淀产生又有气体生成;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀④Ba(AlO2)2可溶于水。
(1)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后生成物是
(2)写出E溶液与过量的B溶液反应的离子方程式
(3)已知NaOH(aq)+ HNO3(aq) =NaNO3(aq) +H2O(l)∆H=-aKJmol-1
请写出B与C的稀溶液反应的热化学方程式:
(4)在100mL0.1mol/L的E溶液中,逐滴加入35mL2mol/L的NaOH溶液,最终得到沉淀的物质的量为
(1)NaCl NaHCO3 (2分)
(2) 2Al3+ +3 SO42- +3Ba2+ + 8OH- = 2AlO2- +3BaSO4 +4H2O (2分)
(3)Ba(OH)(aq) + 2 HCl(aq)= BaCl2 (aq) + 2H2O(l)∆H=-2aKJmol-1 (2分)
(4)0.01mol (2分)

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.