��Ŀ����
(12��)��ҵ�����������������������ȡ������ú�����Fe2+��Fe3+������������Һ�����ȵ�һ���¶ȣ����裬����һ�������������Һ����������Һ������Һ�����ɻ��Զ������̣�������Һ��pH����Ӧһ��ʱ�䣬Fe (OH) 3�Ͷ������̷��������������ã����յõ�������������Ʒ��
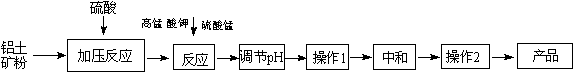
��1��KMnO4���Ƚ�Fe2+����ΪFe3+���䱾������ԭΪMnO2����Ӧ�����ӷ���ʽΪ �� ��
��2��д�����������Һ����������Һ��Ӧ�Ļ�ѧ����ʽ �� ��ʵ��֤����n(MnO2)/n(Fe)������4��1ʱ������Ч���Ϻá�����Һ���������Ӻ�������Ũ�Ⱦ�Ϊ0.03 mol/L��Ϊ�ﵽ�Ϻõij���Ч����ÿ1 L��ҺӦ���������ص����ʵ���Ϊ �� ��
��3������pH�������� �� ��
��4������1������Ϊ �� ������2������Ϊ �� ��
��5�������йع��յ�˵����ȷ���� �� ��������ĸ��ţ�
A����������Һ���ټ���������۵ȵ���pH
B����Һ�ļ���Խǿ�������Ч��Խ�ã���ͬʱ��Ӱ���������IJ���
C�����Զ�������������Ӧ���ˣ�����ʱ����ȥ���ʽϵͣ�����ʱ�����ӳɱ�
D������ֱ������Һ�м���������̷�ĩ�Գ�ȥFe (OH) 3
��12�֣���1��MnO4- + 3Fe2+ + 4H+ = MnO2 + 2H2O + 3Fe3+ ��2�֣�
��2��![]() ��0.102mol�� ��4�֣�
��0.102mol�� ��4�֣�
��3��ʹ�����ӵ�ˮ��Ϊ��������������ȥ�� ��2�֣�
��4�����ˣ������ᾧ����2�֣���5��ABC ��ȫ�Ը�2�֣���1����2�֣�����Ϊֹ��

 ��У����ϵ�д�
��У����ϵ�д�

 ��
��

