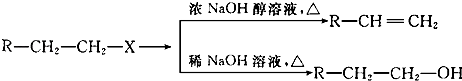题目内容
【题目】现有下列九种物质:①H2②Cu ③CuO ④CO2⑤稀H2SO4⑥稀硝酸 ⑦氨水 ⑧Ba(OH)2固体 ⑨熔融Al2(SO4)3 , 请回答下列问题.(前3个小题填写物质的序号)
(1)上述物质中,属于强碱的是;
(2)上述物质中,在该状态下既是电解质又能导电的是;
(3)上述物质或溶液中若两两反应的离子方程式为:H++OH﹣═H2O则,对应的两种物质是;
(4)上述两种物质的组合后在一定条件下能发生置换反应,请写出其化学方程式是;
(5)在⑧的溶液中通入少量的④,请写出该反应的离子方程式: .
(6)在特殊条件下,金属Al与⑥发生反应的化学方程式为:8Al+30HNO3═8Al(NO3)3+3X+9H2O,该反应中生成的X是一种盐,其化学式为 , 其中还原剂与氧化剂的物质的量之比是 , 当有8.1g Al发生反应时,转移电子的数目为 .
【答案】
(1)⑧
(2)⑨
(3)⑥⑧
(4)H2+CuO ![]() Cu+H2O
Cu+H2O
(5)Ba2++2OH﹣+CO2═BaCO3↓+H2O
(6)NH4NO3,8:3,0.9NA
【解析】解:(1)氨水和氢氧化钙固体均是碱,前者是弱碱,后者是强碱;
(2)熔融状态下能导电的化合物,属于电解质;
(3)硝酸与氢氧化钡反应的实质是氢离子与氢氧根离子反应生成水,可以用离子方程式H++OH﹣═H2O表示,对应反应为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(4)氢气还原氧化铜为置换反应,所以答案是:H2+CuO ![]() Cu+H2O;
Cu+H2O;
(5)在⑧Ba(OH)2固体的溶液中通入少量的④CO2,反应生成碳酸钡,反应的离子方程式Ba2++2OH﹣+CO2═BaCO3↓+H2O,所以答案是:Ba2++2OH﹣+CO2═BaCO3↓+H2O;
(6)8Al+30HNO3=8Al(NO3)3+3X+9H2O,设氮元素化合价降低为x,依据氧化还原反应电子守恒,8×3=3(5﹣x)得到x=﹣3,依据原子守恒则生成的产物NH4NO3;8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O,8molAl做还原剂与3molHNO3做氧化剂的物质的量之比是=8:3,216gAl反应转移电子物质的量为24mol,当有8.1g Al发生反应时,转移电子的物质的量= ![]() =0.9mol,
=0.9mol,
所以答案是:NH4NO3;8:3;0.9NA.
所以答案是:(1)⑧;(2)⑨;(3)⑥⑧;(4)H2+CuO ![]() Cu+H2O;(5)Ba2++2OH﹣+CO2═BaCO3↓+H2O;(6)NH4NO3;8:3;0.9NA.
Cu+H2O;(5)Ba2++2OH﹣+CO2═BaCO3↓+H2O;(6)NH4NO3;8:3;0.9NA.