��Ŀ����
����Ŀ�����ʼ��仯�����ڹ�ũҵ���������Ź㷺��Ӧ�á�
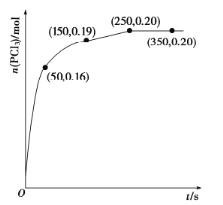
��1���¶�Ϊ![]() ʱ����2.0L�����ܱ������г���1.0 mol
ʱ����2.0L�����ܱ������г���1.0 mol ![]() ��������Ӧ
��������Ӧ![]() ������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�����������ͼ����Ӧ��ǰ50s��ƽ������
������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�����������ͼ����Ӧ��ǰ50s��ƽ������![]() __________����Ӧ�ﵽƽ��������¶ȣ���
__________����Ӧ�ﵽƽ��������¶ȣ���![]() ______���������С�����䡱�����ٴδﵽƽ���
______���������С�����䡱�����ٴδﵽƽ���![]() ��ƽ��Ũ��Ϊ
��ƽ��Ũ��Ϊ![]() ����Ӧ��
����Ӧ��![]() _____���������=��������0��
_____���������=��������0��
��2���¶�Ϊ![]() ʱ����ƽ��ʱ��ϵ����ѹǿΪp���÷�Ӧ��ƽ�ⳣ��
ʱ����ƽ��ʱ��ϵ����ѹǿΪp���÷�Ӧ��ƽ�ⳣ��![]() ______________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
______________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��3���¶�Ϊ![]() ʱ��������Ӧ���ں�ѹ�����н��У���ﵽƽ���
ʱ��������Ӧ���ں�ѹ�����н��У���ﵽƽ���![]() �����ʵ���__________������ڡ���С�ڡ����ڡ���0.20mol��������___________��
�����ʵ���__________������ڡ���С�ڡ����ڡ���0.20mol��������___________��
��4����֪![]() ˮ�������������
ˮ�������������![]() �������£�
�������£�![]() ��Һ��
��Һ��![]() ����������������NaOH��Һ��Ӧ����
����������������NaOH��Һ��Ӧ����![]() ����
����![]() ��
��![]() ��Һ�и�����Ũ���ɴ�С��˳��Ϊ_________________��
��Һ�и�����Ũ���ɴ�С��˳��Ϊ_________________��
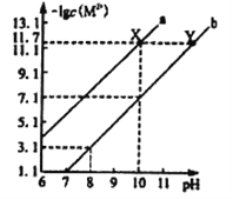
��5�����������ǿ��ԭ�ԣ��ɱ�����Ϊ![]() ��
��![]() ��NaOH��Һ��Ӧ����Ӧ������к������ӵķֲ�������ƽ��ʱij���ӵ�Ũ��ռ����Ũ��֮�͵ķ�������pH�Ĺ�ϵ��ͼ��ʾ��
��NaOH��Һ��Ӧ����Ӧ������к������ӵķֲ�������ƽ��ʱij���ӵ�Ũ��ռ����Ũ��֮�͵ķ�������pH�Ĺ�ϵ��ͼ��ʾ��

��Ϊ��þ����ܴ���![]() ��pHӦ������_________��
��pHӦ������_________��
����֪��25��ʱ��![]() �ĵ��볣��Ϊ
�ĵ��볣��Ϊ![]() ��
��![]() ��
��![]() ����
����![]() ʱ����Һ��
ʱ����Һ��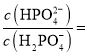 _________��
_________��
���𰸡�![]() ���� ��
���� �� ![]() ����0.042p�� ���� ����ӦΪ�������������ķ�Ӧ���ں�ѹ�����±��ں���������ѹǿС�������ڷ�Ӧ������У�ƽ��ʱ
����0.042p�� ���� ����ӦΪ�������������ķ�Ӧ���ں�ѹ�����±��ں���������ѹǿС�������ڷ�Ӧ������У�ƽ��ʱ![]() �����ʵ�������
�����ʵ������� ![]() 4��5.5�����ڴ������ڵ�����ֵ��������ɣ� 6.2
4��5.5�����ڴ������ڵ�����ֵ��������ɣ� 6.2
��������
(1)����ͼ��֪����Ӧ��ǰ50 s����PCl3�����ʵ���Ϊ0.16 mol�����ݷ�ӦPCl5(g) ![]() PCl3(g)��Cl2(g)֪PCl5�����ʵ����仯Ϊ0.16 mol����Ӧ��ǰ50 s��ƽ������v(PCl5)��0.16 mol��(2 L��50 s)��0.001 6 mol��L��1��s��1����������������ʱ�������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʷ�Ӧ�ﵽƽ��������¶ȣ���v��(Cl2)������ͼ��֪����Ӧ��ƽ���n(PCl3)��0.2 mol�����������Ϊ2 L��c(PCl3)��0.1 mol��L��1�������¶ȣ���Ӧ�ٴδﵽƽ���PCl3��ƽ��Ũ��Ϊ0.18 mol��L��1��˵�������¶ȣ�ƽ�������ƶ�����������������ʱ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����Ӧ����H��0��
PCl3(g)��Cl2(g)֪PCl5�����ʵ����仯Ϊ0.16 mol����Ӧ��ǰ50 s��ƽ������v(PCl5)��0.16 mol��(2 L��50 s)��0.001 6 mol��L��1��s��1����������������ʱ�������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʷ�Ӧ�ﵽƽ��������¶ȣ���v��(Cl2)������ͼ��֪����Ӧ��ƽ���n(PCl3)��0.2 mol�����������Ϊ2 L��c(PCl3)��0.1 mol��L��1�������¶ȣ���Ӧ�ٴδﵽƽ���PCl3��ƽ��Ũ��Ϊ0.18 mol��L��1��˵�������¶ȣ�ƽ�������ƶ�����������������ʱ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����Ӧ����H��0��
(2)����ͼ���Ϸ�ӦPCl5(g)![]() PCl3(g)��Cl2(g)֪�¶�ΪT��ʱ����Ӧ�ﵽƽ���n(Cl2)��n(PCl3)��0.2 mol��n(PCl5)��0.8 mol������������������ʵ���Ϊ1.2 mol�����������Ȼ��ס����Ȼ������ʵ��������ֱ�Ϊ1/6��1/6��2/3����ƽ��ʱ��ϵ����ѹǿΪp�����������Ϣ֪���������Ȼ��ס����Ȼ���ƽ���ѹ�ֱ�Ϊp/6��p/6��2p/3���÷�Ӧ��ƽ�ⳣ��Kp��
PCl3(g)��Cl2(g)֪�¶�ΪT��ʱ����Ӧ�ﵽƽ���n(Cl2)��n(PCl3)��0.2 mol��n(PCl5)��0.8 mol������������������ʵ���Ϊ1.2 mol�����������Ȼ��ס����Ȼ������ʵ��������ֱ�Ϊ1/6��1/6��2/3����ƽ��ʱ��ϵ����ѹǿΪp�����������Ϣ֪���������Ȼ��ס����Ȼ���ƽ���ѹ�ֱ�Ϊp/6��p/6��2p/3���÷�Ӧ��ƽ�ⳣ��Kp��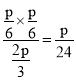 ��(��0.042p)��
��(��0.042p)��
(3)��ӦPCl5(g)![]() PCl3(g)��Cl2(g)������Ϊ�������ʵ�������ķ�Ӧ���¶�ΪT��ʱ������Ӧ�ں�ѹ�����н��У����ŷ�Ӧ�Ľ��У���������������ʵ���������Ҫ��ά��������ѹǿ���䣬�������ݻ�Ӧ������������൱�ڼ�Сѹǿ�����൱��ԭƽ���������������ķ����ƶ����ﵽƽ���PCl3�����ʵ�������0.20 mol��
PCl3(g)��Cl2(g)������Ϊ�������ʵ�������ķ�Ӧ���¶�ΪT��ʱ������Ӧ�ں�ѹ�����н��У����ŷ�Ӧ�Ľ��У���������������ʵ���������Ҫ��ά��������ѹǿ���䣬�������ݻ�Ӧ������������൱�ڼ�Сѹǿ�����൱��ԭƽ���������������ķ����ƶ����ﵽƽ���PCl3�����ʵ�������0.20 mol��
(4)���������Ϣ֪������(H3PO3)Ϊ��Ԫ���ᣬNa2HPO3Ϊ�������γɵ����Σ�Ǩ��Na2CO3��Һ��������0.10 mol��L��1��Na2HPO3��Һ�ʼ��ԣ�һ��ˮ��Զ���ڶ���ˮ���������ˮ�������ģ�����Һ�и�����Ũ���ɴ�С��˳����![]() ��
��
(5)�ٷ���ͼ��֪����þ����ܴ���NaH2PO4��pHӦ������4��5.5(���ڴ������ڵ�����ֵ���������)��
�ڷ���ͼ��֪����pH��8ʱ����Һ�еĺ�����ΪH2PO4����HPO42����c(H��)��1��10��8 mol��L��1����Ka2��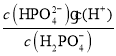 ��6.2��10��8 mol��L��1����
��6.2��10��8 mol��L��1����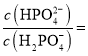 6.2��
6.2��

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д�