题目内容
怎样理解化学反应中放热或吸热的原因?
答案:
解析:
解析:
|
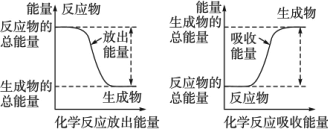
明确化学反应的实质在化学反应中,从反应物分子转变为生成物分子,原子间的结合方式发生了根本改变.整个过程中,反应物分子中的化学键部分或全部遭到破坏.实验证明,在破坏旧化学键时,需要吸收能量来克服原子间的相互吸引;在生成新化学键时,由于原子间的相互吸引而释放能量.化学反应中的热量就来源于旧化学键的断裂和新化学键的生成所发生的能量变化. 化学反应中所有的生成物的能量之和[E(生成物)]与所有反应物能量之和[E(反应物)]一般是不等的.若反应中无其他能量体现,化学反应不是放热就是吸热.反应热的大小取决于生成物和反应物的能量之差.若E(生成物)>E(反应物),则反应吸热;若E(生成物)<E(反应物),则反应放热,因而化学反应不仅有新物质的产生,同时还伴有能量变化.前者遵循质量守恒定律,后者符合能量守恒定律.所以欲在不消耗任何物质和能量的前提下,利用某种体系不断地产生新物质和能量的设想是荒谬的. 具体而言,反应热的大小与反应物、生成物的种类、量及聚集状态有关,与反应途径无关.根据能量守恒定律,无论反应是一步完成还是几步完成,只要反应的起始状态和终了状态确定,反应热就是个定值,这就是著名的盖斯定律:化学反应中的能量变化只与反应物的量和最终产物有关,与中间反应过程无关. 结合下图来理解化学反应中的能量变化.
|

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目