题目内容
判断下列示意图是否正确?为什么? ![]()
解析:
| 答案:(A、B、C、D均错)A、B违反了最外层电子数为8的排布规律,C的第一电子层上应为2个电子,D项不符合次外层电子数不超过18的排布规律.
|

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案(13分)碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
(4)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 ,判断依据是 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在下图中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。

氮是地球上含量丰富的一种元素,氮及其化合拖把在工农业生产、生活中有着重要作用。请回答:
(1)右图是1molNO2和1molCO反应生成
和NO过程中能量变化示意图,请写出
NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) ![]() 2NH3(g),其化学
2NH3(g),其化学
平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小;K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保护不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出墁酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5?H2O+])+c(H+)= c(H+)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)>
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
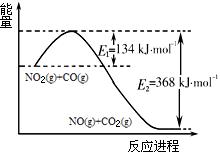
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变

(3)对反应N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N?2的转化率a(N2)= , 以NH3表示该过程的反应速率v(NH3)= 。
氮是地球上含量丰富的一种元素,氮元素的
单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应
的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N?2的转化率a(N2)= , 以NH3表示该过程的反应速率v(NH3)= 。
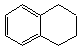 ,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2