题目内容
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
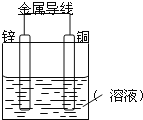
Ⅰ.若电解质溶液为稀硫酸,
(1)Zn棒为原电池的___极,其电极反应式为:___。
(2)Cu棒为原电池的___极,其电极反应式为:___。
Ⅱ.以KOH溶液为电解质溶液,写出甲烷燃料电池的电极反应式
负极反应式:___。
正极反应式:___。
【答案】负 Zn-2e-=Zn2+ 正 2H++2e-=H2↑ CH4+10OH- - 8e-=CO32- +7H2O 2O2+8e-+4H2O=8OH-
【解析】
I. 在硫酸溶液中,Zn比Cu活泼,故Zn作负极,发生反应Zn-2e-=Zn2+,Cu作正极,氢离子在Cu电极上得电子,2H++2e-=H2↑;
II. 甲烷燃料电池,甲烷为电池负极,电极反应式为CH4+10OH- - 8e-=CO32- +7H2O,氧气作正极,电极反应式为2O2+8e-+4H2O=8OH-。

练习册系列答案
相关题目