题目内容
A-E是周期表中1-36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中.对它们的性质及结构的描述如下.
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的绝对值相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D元素在周期表中位C元素的下一周期,其电负性在同周期元素中最大;E原子最外层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素.
(1)请写出E原子基态的电子排布式 .
(2)B、C、D的最高价氧化物对应的水化物的酸性由强到弱的顺序为 (写化学式).
(3)写出D离子的最外层电子排布式 ,并写出B原子价e一的轨道表示式 .
(4)写出A、C形成的最简单化合物和A、D形成的化合物恰好反应生成的盐的溶液显 性,原因是 (用离子反应方程式表示).并把溶液中的离子的浓度由大到小排序 (用离子符号表示).
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的绝对值相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D元素在周期表中位C元素的下一周期,其电负性在同周期元素中最大;E原子最外层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素.
(1)请写出E原子基态的电子排布式
(2)B、C、D的最高价氧化物对应的水化物的酸性由强到弱的顺序为
(3)写出D离子的最外层电子排布式
(4)写出A、C形成的最简单化合物和A、D形成的化合物恰好反应生成的盐的溶液显
考点:位置结构性质的相互关系应用
专题:
分析:A原子的基态只有一种形状的电子云,并容易形成共价键,则A是H元素;
B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;
C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;
D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;
E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素,据此进行解答.
B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;
C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;
D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;
E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素,据此进行解答.
解答:
解:A原子的基态只有一种形状的电子云,并容易形成共价键,则A是H元素;B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素,
(1)E是29号元素,其原子核外有29个电子,根据构造原理知,其原子基态的电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)非金属性越强,最高价氧化物对应的水化物的酸性越强,由于非金属性:Cl>N>C,则最高价氧化物对应的水化物的酸性强弱为:HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)D离子为氯离子,氯离子最外层有8个电子,s能级上有2个电子,p能级上有6个电子,所以氯离子的最外层电子排布式:3s23p6;
B为C元素,碳原子价电子为2s、2p,各含有2个分子,碳原子的价电子轨道表示式为 ,
,
故答案为:3s23p6; ;
;
(4)A、C形成的最简单化合物为氨气,A、D形成的化合物为HCl,氨气与氯化氢恰好反应生成的盐为氯化铵,由于铵根离子部分水解,溶液显示酸性,铵根离子的水解的离子方程式为:NH4++H2O=NH3?H2O+H+;铵根离子水解,则氯离子浓度大,水解显酸性,则氢离子浓度大,且显性离子大于隐性离子,则离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O=NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(1)E是29号元素,其原子核外有29个电子,根据构造原理知,其原子基态的电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)非金属性越强,最高价氧化物对应的水化物的酸性越强,由于非金属性:Cl>N>C,则最高价氧化物对应的水化物的酸性强弱为:HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)D离子为氯离子,氯离子最外层有8个电子,s能级上有2个电子,p能级上有6个电子,所以氯离子的最外层电子排布式:3s23p6;
B为C元素,碳原子价电子为2s、2p,各含有2个分子,碳原子的价电子轨道表示式为
 ,
,故答案为:3s23p6;
 ;
;(4)A、C形成的最简单化合物为氨气,A、D形成的化合物为HCl,氨气与氯化氢恰好反应生成的盐为氯化铵,由于铵根离子部分水解,溶液显示酸性,铵根离子的水解的离子方程式为:NH4++H2O=NH3?H2O+H+;铵根离子水解,则氯离子浓度大,水解显酸性,则氢离子浓度大,且显性离子大于隐性离子,则离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O=NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,能够根据盐的水解原理、电荷守恒、物料守恒判断溶液中各离子浓度大小.

练习册系列答案
相关题目
下列实验不合理的是( )
A、 制取氨气 |
B、 分离乙醇和乙酸乙酯混合液 |
C、 电解精炼铜 |
D、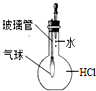 验证HCl极易溶于水 |
某溶液可能含有Na+、Fe3+、Br-、I-、HCO3-、SO32-、NO3-等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是( )
| A、Na+、I-、SO32- |
| B、Na+、Br-、SO32- |
| C、Fe3+、Br-、NO3- |
| D、Na+、Br-、NO3- |
下列叙述不正确的是( )
| A、淀粉、油脂、蛋白质都能水解,且水解产物各不相同 |
| B、石油催化裂化的主要目的是提高芳香烃的产量 |
| C、从煤的干馏产物中可以获得焦炉气、粗氨水、煤焦油、焦炭等重要的化工原料 |
| D、误服重金属盐,立即服用牛奶或豆浆可解毒 |
