题目内容
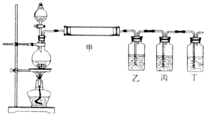
在实验室中制取少量乙酸乙酯的主要步骤如下:
①把2 mL乙醇、l mL浓硫酸装入反应的试管中,再加入2 mL l0%的醋酸.
②在收集试管中,装入饱和的NaOH溶液,组装好全部装置.
③将反应试管加强热,保持剧烈沸腾.
④倒出收集试管中的上层液体,即得到产品乙酸乙酯.
指出以上①~④步骤中的主要错误,并回答有关问题:
错误处并改正:
①________________,
②________________,
③________________,
④________________.
问题:
(1)步骤③操作的作用是什么?________________.
(2)收集试管中的导管为什么不能插入溶液中?________________.
(3)乙酸乙酯的主要用途是________________.
答案:
解析:
解析:
|
①不能用10%的醋酸,应该用纯醋酸. ②应在收集乙酸乙酯的试管中盛饱和Na2CO3溶液,不能用NaOH溶液. ③应小火加热保持微沸,不能将反应试管加强热,并保持剧烈沸腾. ④应用分液漏斗分离出乙酸乙酯,不能倒出收集试管中的上层液体. (1)使酯化反应充分,并将乙酸乙酯蒸出. (2)防止饱和Na2CO3溶液被倒吸入反应试管. (3)做香料、做溶剂 |

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目