题目内容
3.下列对元素周期表和元素周期律的认识正确的是( )| A. | d区元素全部是金属元素 | B. | 第IA元素从上到下熔沸点依次降低 | ||
| C. | 短周期元素从左到右I1依次增大 | D. | 电负性最大的元素是He |
分析 A.d区元素属于过渡金属元素;
B.第IA族元素,原子半径逐渐增大、金属性逐渐增强,但其单质的熔沸点先增大后减小;
C.同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大;
D.电负性最大的元素为F.
解答 解:A.由元素核外电子排布可知d区元素属于过渡金属元素,都是金属,故A正确;
B.第IA族元素,原子半径逐渐增大、金属性逐渐增强,但其单质的熔沸点先增大后减小,故B错误;
C.元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越稳定其第一电离能越大,同周期从左到右元素的第一电离能逐渐增大,但同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大,故C错误;
D.元素非金属性越强,电负性越大,原子对键合电子的吸引力越大,同主族从上到下元素的电负性逐渐减小,同周期从左到右电负性逐渐增大,则电负性最大的元素为F,故D错误.
故选A.
点评 本题考查元素周期表的结构,为基础性习题,把握周期表中的周期、族为解答的关键,注意H的位置及元素种类,题目难度不大.

练习册系列答案
相关题目
14.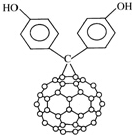 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )| A. | C60的二苯酚基化合物属于芳香烃 | |
| B. | C60的二苯酚基化合物分子式为C73H12O2 | |
| C. | C60的二苯酚基化合物能与氢氧化钠溶液反应 | |
| D. | 1mol C60的二苯酚基化合物最多可以与6mol H2发生加成反应 |
18.下列各项表达式中正确的是( )
| A. | Na原子简化的核外电子排布式:[Na]3s1 | |
| B. | Cr原子的价电子排布式:3d54s1 | |
| C. | NH4Cl的电子式: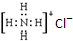 | |
| D. | Fe原子的结构示意图: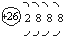 |
8.下列说法中不正确的是( )
| A. | H2O和H2O2两种分子中O原子的杂化类型相同 | |
| B. | NH3和NH4+两种微粒的空间结构相同 | |
| C. | SO42-和ClO4-两种微粒的键角相等 | |
| D. | SO2和O3两种分子是等电子体 |
15.下列说法正确的是( )
| A. | 按系统命名法,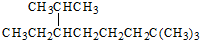 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 | |
| B. | 青蒿素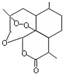 是抗恶性疟疾特效药,其分子式为C15H20O5 是抗恶性疟疾特效药,其分子式为C15H20O5 | |
| C. | 1mol达菲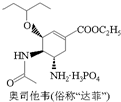 最多能与4molNaOH反应 最多能与4molNaOH反应 | |
| D. | CH3CH=CH-CH=CH2与溴的四氯化碳溶液发生加成反应最多可生成3种产物 |

 ;
; +(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+
+(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+ ;
;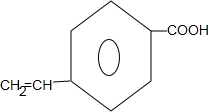 .
.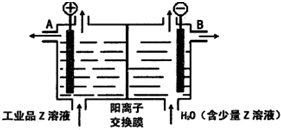 A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题:
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题: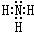 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.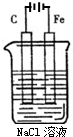 如图是电解NaCl溶液的示意图.请回答下列问题:
如图是电解NaCl溶液的示意图.请回答下列问题: