题目内容
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+![]() O2(g)
O2(g)![]() CO2(g)ΔH=-283.0 kJ·mol-1
CO2(g)ΔH=-283.0 kJ·mol-1
C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
解析:由热化学方程式可得出相同质量的H2、CO、C8H18、CH4放出的热量分别为H2:![]() ×285.8 kJ=
×285.8 kJ=![]() ×283.0 kJ=
×283.0 kJ=![]() ×5 518 kJ=
×5 518 kJ=![]() ×890.3 kJ=
×890.3 kJ=
拓展:由该题可知,等质量的H2、CO、C8H18、CH4燃烧时,放热最多的是H2。因此,H2被公认为是21世纪替代化石燃料的理想能源。当然,作为理想能源,H2还有以下优点:燃烧产物为水,不产生污染,H2是一种再生能源。
答案:B

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: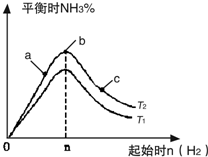 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: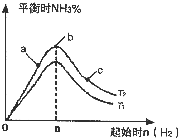 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: