题目内容
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
| B、500s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| C、T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
B、依据图标数据分析计算500s内N2O5(g)消耗的浓度计算分解率;
C、由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算平衡浓度结合平衡常数概念计算平衡常数,根据转化率=
| 浓度变化量 |
| 起始浓度 |
D、运用平衡移动原理分析.
B、依据图标数据分析计算500s内N2O5(g)消耗的浓度=5.00mol/L-3.52mol/L=1.48mol/L,分解速率=
| 1.48mol/L |
| 500s |
C、由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,平衡常数K=
| c(O2)c4(NO2) |
| c2(N2O5) |
| 1.25×54 |
| 2.52 |
| 5mol/L-2.5mol/L |
| 5mol/L |
D、由于2N2O5(g)?4NO2(g)+O2(g)是气体体积变小的反应,体积压缩为原来一半时,平衡要逆向移动,N2O5的浓度比原来双倍还要多,压缩前c(N2O5)=2.50mol?L-1则压缩后c(N2O5)>5.00mol?L-1,故D正确;
故选A.

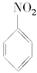
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是____________________________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将___________。(填““增大”“减小”或“不变”)
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1 000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500 s内N2O5的分解速率为__________。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
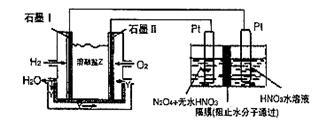
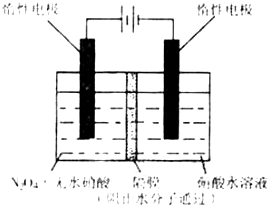
(3)下图所示装置可用于制备N2O5,则N2O5在电解池的_______区生成,其电极反应式为____________________________________________________________________。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2 O5可发生下列反应:
![]() 2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为 。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。
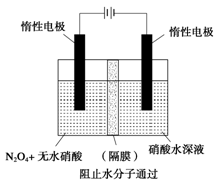 |
(3)如上图所示装置可用于制备N2O5,则N2O5在电解池的
区生成,其电极反应式为 .
 (2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.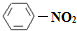
 Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是
Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是