题目内容
25℃时,某溶液中由水电离出的c(OH﹣)=1×10﹣13mol/L,该溶液中一定不能大量共存的离子组是
A. NH4+、Fe3+、SO42-、Cl- B. HCO3-、Na+、HSO3-、K+
C. Na+、SO42-、NO3-、Cl- D. CO32-、PO43-、K+、Na+
 阅读快车系列答案
阅读快车系列答案下列实验操作和现象所得结论正确的是
选项 | 操作 | 现象 | 结论 |
A | 向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液 | NaNO3溶液为无色,Na2SiO3溶液变成红色 | 非金属性:N>Si |
B | 将湿润的KI—淀粉试纸置于集满某气体的集气瓶口 | 试纸变蓝 | 该气体为Cl2 |
C | 将浓盐酸滴入NaHSO3溶液,所得气体依次通过浓硫酸和CuSO4,收集气体 | CuSO4颜色未发生改变 | 收集到纯净的SO2 |
D | 向含有少量FeCl3的FeCl2溶液中加入铜粉 | 铜粉有剩余 | 所得溶液中的溶质只有FeCl2 |
A. A B. B C. C D. D
下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3>C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向Na2SO4和Na2CO3混合溶液中滴入AgNO3溶液 | 产生白色浑浊 | Ksp(Ag2SO4)< Ksp(Ag2CO3) |
A. A B. B C. C D. D
硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于 滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
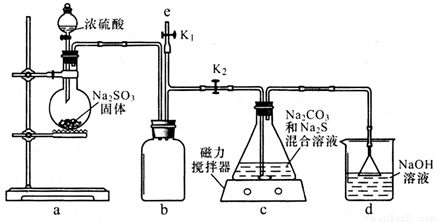
I.制备 Na2S2O3
(1)如图,关闭K1打开K2, 反应开始后,装置c中的产物除 了 Na2S2O3外还有一种无色无味 的气体,这种气体是______。
(2)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1 ,其目的是_______________。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3 CH2O晶体。
(3)实验结束后,装置d中的溶质可能有__________________。
探究Na2S2O3的部分化学性质
【分析推理】Na2S2O3可以看成是一个S原子取代了 Na2SO4中一个O原子形成的。据此 推测,下列说法正确的是____________。
A.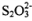 和
和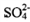 都是正四面体结构 B.
都是正四面体结构 B.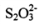 中硫硫键的键长大于硫氧键
中硫硫键的键长大于硫氧键
C.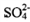 中的键角均为
中的键角均为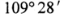 D.
D.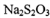 中所有原子都满足8电子结构
中所有原子都满足8电子结构
【提出假设】①Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7。②从S元素的化合价推测Na2S2O3具有较强的还原性。
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空):
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
① | ___________________ | 溶液pH=8 | ___________ |
② | 向新制氯水中滴入适量Na2S2O3溶液 | 氯水褪色 | _____________ |
【实验结论】__________________


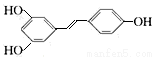 ,根据要求回答问题:
,根据要求回答问题: 属于脂环化合物 C.它属于芳香化合物 D.它属于烃的衍生物
属于脂环化合物 C.它属于芳香化合物 D.它属于烃的衍生物
 2-甲基-3-丙基戊烷 B.
2-甲基-3-丙基戊烷 B.  2-乙基丁烷
2-乙基丁烷 2-甲基-1-丙醇 D.
2-甲基-1-丙醇 D.  3-甲基-1-丁烯
3-甲基-1-丁烯 Cl 与
Cl 与 Cl 得电子能力相同
Cl 得电子能力相同