题目内容
【题目】ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
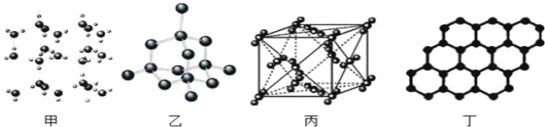
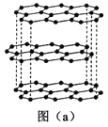
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为_______,原子间存在的共价键类型有________,碳原子的杂化轨道类型为________。
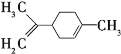
(2)SiCl4分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
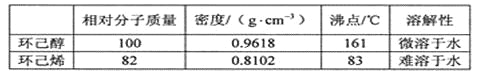
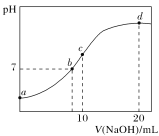
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______。(填“增强”“不变”或“减弱”)
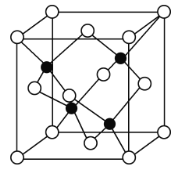
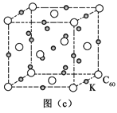
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_________。
【答案】混合型晶体 σ键、π键 sp2 正四面体 非极性 均为分子晶体,范德华力随分子相对质量增大而增大 减弱 K3C60
【解析】
根据晶胞结构判断晶体类型及原子间存在的共价键类型,根据杂化轨道及价电子互斥理论判断分析立体构型与中心原子的杂化方式,利用范德华力的大小解释分子晶体熔沸点的变化规律,根据均摊法确定化合物的化学式。
(1)该单质为石墨,属于混合型晶体,在石墨晶体中,同层的每一个碳原子以sp2杂化轨道与相邻的三个碳原子以σ键结合,六个碳原子在同一个平面上形成了正六边形的环,伸展成片层结构,在同一平面的碳原子还各剩下一个p轨道,其中有一个2p电子。这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键,故答案为:混合型晶体;σ键、π键;sp2;;
(2)SiCl4中心原子是Si,有4个σ键,孤电子对数为![]() ,价层电子对数为4,空间构型为正四面体,该分子中正负中心电荷相互重合,属于非极性分子,故答案为:正四面体;非极性;
,价层电子对数为4,空间构型为正四面体,该分子中正负中心电荷相互重合,属于非极性分子,故答案为:正四面体;非极性;
(3)①SiX4属于分子晶体,不含分子间氢键,范德华力越大,熔沸点越高,范德华力随着相对分子质量的增大而增大,即熔沸点逐渐升高,故答案为:均为分子晶体,范德华力随分子相对质量增大而增大;
②同主族从上到下非金属性减弱,得电子能力减弱,因此PbX2中化学键的离子型减弱,故答案为:减弱;
(4)根据晶胞的结构,C60位于顶点和面心,个数为![]() ,K为与棱上和内部,个数为
,K为与棱上和内部,个数为![]() ,因此化学式为K3C60,故答案为:K3C60。
,因此化学式为K3C60,故答案为:K3C60。

 学业测评一课一测系列答案
学业测评一课一测系列答案