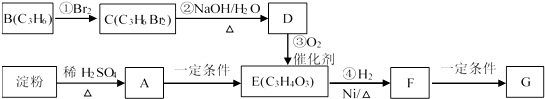
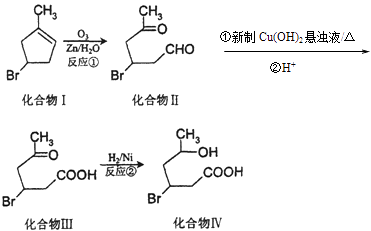
题目内容
【题目】一定温度下,在2L的密闭容器中,M、N 两种气体的物质的量随时间变化的曲线如图所示:

(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是______min,该时间内的平均反应速率v(N)=______。
(3)反应达到平衡状态时,放中6QkJ的热量,当容器中充入lmolN,反应放出的热量为_____。
①等于QkJ ②小于QkJ ③大于QkJ ④等于2QkJ
(4)判断该反应达到平衡状态的依据是__________。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的密度不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2molN的同时,生成1molM
(5)能能加快反应速率的措施是_________。
①升高温度 ②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar ④使用催化剂
【答案】 2N![]() M 6 0.5 mol/(L·min) 或0.5 mol·L-1·min-1 ② ③ ①④
M 6 0.5 mol/(L·min) 或0.5 mol·L-1·min-1 ② ③ ①④
【解析】(1)反应进行到4min时N减少8mol-4mol=4mol,M增加4mol-2mol=2mol,因此反应的化学方程式为2N![]() M。(2)根据图像可知反应进行到6min时物质的物质的量不再发生变化,因此反应达到最大限度的时间是6min,该时间内的平均反应速率v(N)=
M。(2)根据图像可知反应进行到6min时物质的物质的量不再发生变化,因此反应达到最大限度的时间是6min,该时间内的平均反应速率v(N)= ![]() =0.5 mol/(L·min)。(3)反应达到平衡状态时,放出6QkJ的热量,即消耗6molN放出6QkJ的热量,由于是可逆反应,则1molN不能完全消耗,所以反应放出的热量为小于QkJ,答案选②;(4)①达到平衡状态时正逆反应速率相等,但不能为零,错误;②密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此该条件下,混合气体的密度不再发生变化不能说明反应达到平衡状态,错误;③正反应体积减小,则该条件下,混合气体的压强不再发生变化能说明反应达到平衡状态,正确;④该条件下,单位时间内消耗2molN的同时,生成1molM均表示正反应速率,不能说明反应达到平衡状态,错误;答案选③;(5)①升高温度反应速率加快;②容器体积不变,充入隋性气体Ar,反应物浓度不变,反应速率不变;③容器压強不变,充入惰性气体Ar,容器容积增大,反应物浓度减小,反应速率减小;④使用催化剂反应速率加快;答案选①④。
=0.5 mol/(L·min)。(3)反应达到平衡状态时,放出6QkJ的热量,即消耗6molN放出6QkJ的热量,由于是可逆反应,则1molN不能完全消耗,所以反应放出的热量为小于QkJ,答案选②;(4)①达到平衡状态时正逆反应速率相等,但不能为零,错误;②密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此该条件下,混合气体的密度不再发生变化不能说明反应达到平衡状态,错误;③正反应体积减小,则该条件下,混合气体的压强不再发生变化能说明反应达到平衡状态,正确;④该条件下,单位时间内消耗2molN的同时,生成1molM均表示正反应速率,不能说明反应达到平衡状态,错误;答案选③;(5)①升高温度反应速率加快;②容器体积不变,充入隋性气体Ar,反应物浓度不变,反应速率不变;③容器压強不变,充入惰性气体Ar,容器容积增大,反应物浓度减小,反应速率减小;④使用催化剂反应速率加快;答案选①④。

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)