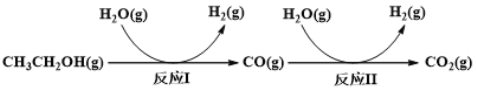��Ŀ����
����Ŀ��ij�¶������ܱ������з�����ӦN2(g)��3H2(g)![]() 2NH3(g) ��H����92.4 kJ/mol������˵����ȷ����
2NH3(g) ��H����92.4 kJ/mol������˵����ȷ����
A. ��1.0 mol N2��3.0 mol H2����1 L�ܱ������з�����Ӧ���ų�������Ϊ92.4 kJ
B. ������Ӧ��ƽ������ݻ����䣬�ٳ���1.0 mol������N2��ת�������
C. ������Ӧ�ڴﵽƽ�����С�ݻ�����ѹǿ��H2��ת�������
D. �����¶ȣ�ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ������������Ӧ���ʼ�С
���𰸡�C
��������
A���Ȼ�ѧ����ʽN2(g)��3H2(g) ![]() 2NH3(g) ��H����92.4 kJ/mol����ʾ1mol������3mol������Ӧ����2mol����,�ų�������Ϊ92.4kJ,��Ϊ���淴Ӧ��Ӧ�ﲻ����ȫת��,1.0mol������3mol����,����1L�ܱ������з�����Ӧ,�ų�������С��92.4kJ,��A������B��������Ӧ��ƽ������ݻ����䣬�ٳ���1.0 mol�����������Ƕ������壬ֻ�ı���������ѹ����N2��H2��NH3�ķ�ѹ����ı䣬���Բ���Ӱ�컯ѧƽ���ƶ���N2��ת���ʲ��䣬��B������C������ѹǿƽ�������������С�ķ����ƶ�,��������Ӧ�ƶ�,H2��ת�������,����C��ȷ��D�������¶������淴Ӧ���ʶ�����ƽ�������ȷ����ƶ���N2(g)��3H2(g)
2NH3(g) ��H����92.4 kJ/mol����ʾ1mol������3mol������Ӧ����2mol����,�ų�������Ϊ92.4kJ,��Ϊ���淴Ӧ��Ӧ�ﲻ����ȫת��,1.0mol������3mol����,����1L�ܱ������з�����Ӧ,�ų�������С��92.4kJ,��A������B��������Ӧ��ƽ������ݻ����䣬�ٳ���1.0 mol�����������Ƕ������壬ֻ�ı���������ѹ����N2��H2��NH3�ķ�ѹ����ı䣬���Բ���Ӱ�컯ѧƽ���ƶ���N2��ת���ʲ��䣬��B������C������ѹǿƽ�������������С�ķ����ƶ�,��������Ӧ�ƶ�,H2��ת�������,����C��ȷ��D�������¶������淴Ӧ���ʶ�����ƽ�������ȷ����ƶ���N2(g)��3H2(g) ![]() 2NH3(g) ��H����92.4 kJ/mol���Ƿ��ȷ�Ӧ���淴Ӧ���ʱȽ�����Ӧ�����������,��D�������ʴ�ѡC��
2NH3(g) ��H����92.4 kJ/mol���Ƿ��ȷ�Ӧ���淴Ӧ���ʱȽ�����Ӧ�����������,��D�������ʴ�ѡC��

 �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�����Ŀ������ʵ������������ȷ����(����)
ѡ�� | ʵ �� | �� �� |
A | ��Na2CO3��Һ��ͨ��������CO2���� | ���������� |
B | �ھƾ����ϼ������� | �����ۻ���ʧȥ�����ۻ��������������� |
C | ������ڿ����е�FeSO4��Һ�еμ�NaOH��Һ | ���̲���������ɫ���� |
D | ���ȷ��������е�С���� | �����ۻ��ɹ�����С��ȼ��ʱ����Ϊ��ɫ��ȼ�պ����ɵ���ɫ���� |
A. A B. B C. C D. D