题目内容
【题目】硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS)。羰基硫可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。反应方程式为:
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
①羰基硫的电子式为_________其含有的共价键类型是________共价键。
②下列能说明碳与硫两元素非金属性相对强弱的是_____________。
a.相同条件下水溶液的pH:Na2CO3 > Na2SO4
b.酸性:H2SO3 > H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式__________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
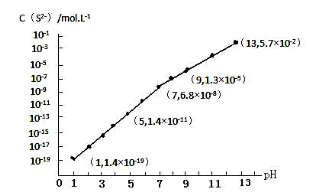
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
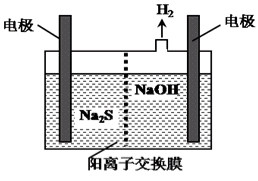
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:______________________。
②Na2S溶液中离子浓度由大到小顺序:________________________。
【答案】(1)①![]() ;极性(各1分,其余均为2分);②ac
;极性(各1分,其余均为2分);②ac
(2)5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O
(3)①0.043;②5
(4)①2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
②c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)
【解析】
试题分析:(1)①羰基硫与二氧化碳是等电子体,其结构相似,根据二氧化碳电子式书写羰基硫电子式为![]() ;不同非金属元素之间易形成极性键,所以该分子中存在极性键,故答案为:
;不同非金属元素之间易形成极性键,所以该分子中存在极性键,故答案为:![]() ;极性;
;极性;
②a.相同条件下水溶液的pH:NaHCO3 > NaHSO4,可知硫酸酸性大于碳酸,则非金属性S > C,故选;b.亚硫酸不是最高价含氧酸,则酸性:H2SO3 > H2CO3,不能比较非金属性,故不选;c.S与H2的化合比C与H2的化合更容易,则非金属性S > C,故选;故答案为:ac;
(2)该反应中S元素化合价由-2价变为0价、+6价,Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,故答案为:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=![]() =
=![]() mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,故答案为:5;
mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,故答案为:5;
(4)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
②硫离子存在两步水解,且第一步水解程度远远大于第二步,两步水解都生成OH-,溶液呈碱性,溶液中氢离子浓度很小,所以离子浓度大小顺序是c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+),故答案为:c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+)。

 中考解读考点精练系列答案
中考解读考点精练系列答案