题目内容
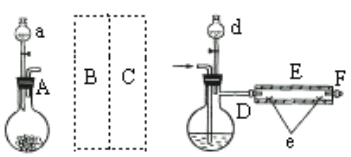
【题目】V2O5可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,具有强氧化性,属于两性氧化物。某研究小组将从钒铅锌矿(主要含有V2O5、PbO、ZnO、CaO)中提取V2O5及回收铅、锌等金属。工艺流程如下图所示:
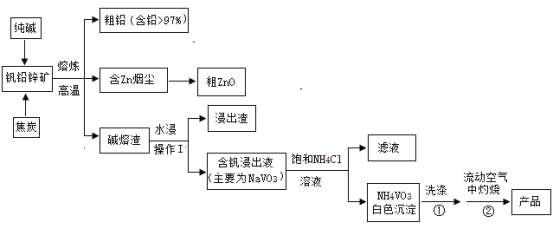
已知:NH4VO3是白色粉末,可溶于热水,微溶于冷水,不溶于乙醇、乙醚。2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)钒铅锌矿高温熔炼时,生成金属铅的反应属于基本反应类型中的________反应; V2O5与纯碱反应的化学方程式为_______________________。
(2)流程中操作I的名称是_______________________。
(3)焦炭用量对还原熔炼效果的影响如下左图所示。分析图像可知,焦炭用量应取矿石质量的约______% 较为合适。

(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,理由是___________。
(5)为制取纯度较高的V2O5,往含钒浸出液(主要为NaVO3)中加NH4Cl溶液,该反应的化学方程式是_________________________。
(6)在洗涤①操作时,可选用的洗涤剂________ (填选项字母)。
A.乙醚 B.1% NH4Cl 溶液 C.热水 D.冷水
(7)在灼烧②操作时,需在流动空气中灼烧的可能原因_____________________。
【答案】置换 V2O5+Na2CO3![]() 2NaVO3+ CO2↑ 过滤 10 液固比为2:1时,钒浸出率在97%以上,再进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量的增大。 NaVO3+NH4Cl=NaCl+NH4VO3↓ BD 若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率
2NaVO3+ CO2↑ 过滤 10 液固比为2:1时,钒浸出率在97%以上,再进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量的增大。 NaVO3+NH4Cl=NaCl+NH4VO3↓ BD 若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率
【解析】
(1)反应过程中加入了单质碳,反应生成单质金属铅,反应属于基本反应类型中的置换反应。V2O5与纯碱反应生成NaVO3和 CO2气体,故反应方程式为V2O5+Na2CO3![]() 2NaVO3+ CO2↑ 。
2NaVO3+ CO2↑ 。
故答案为 置换 V2O5+Na2CO3![]() 2NaVO3+ CO2↑
2NaVO3+ CO2↑
(2)流程中操作I是分离难溶性固体与可溶性液体混合物,名称是过滤。
故答案为 过滤
(3)根据焦炭用量对还原熔炼效果的影响图像可知,焦炭用量应取矿石质量的约10%较为合适。
故答案为 10
(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,这时浸出率为97%以上,为进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量增大等问题;
故答案为 液固比为2:1时,钒浸出率在97%以上,再进一步增大液固比,钒浸出率提高不明显,而且还会导致浸出用水量、废水排放量的增大。
(5)往含钒浸出液中加NH4Cl溶液,发生反应NaVO3+NH4Cl=NaCl+NH4VO3↓,该反应属于基本反应类型中的复分解反应。
故答案为 NaVO3+NH4Cl=NaCl+NH4VO3↓
(6)已知NH4VO3可溶于热水,微溶于冷水,不溶于乙醇、乙醚。且为减小产物的损失,可以选择1% NH4Cl 溶液和冷水进行洗涤。
故答案为 BD
(7)灼烧操作②的过程中由NH4VO3灼烧得到V2O5和NH3↑,若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率,故要在流通的热空气中进行。
故答案为若空气不流通,由于V2O5具有强氧化性,会与还原性的NH3反应,从而影响产物的纯度及产率。

 期末集结号系列答案
期末集结号系列答案【题目】下表中有关变化和反应的对应关系正确的是( )
A | 蒸馏;干馏 | 均为物理变化 |
B | 2FeCl3+Cu=2FeCl2+CuCl2; SiO2+2C | 均为置换反应 |
C | Cl2通入品红溶液中,品红褪色;木炭加入品红溶液中,振荡,褪色 | 前者为化学变化,后者为物理变化 |
D | 在沸水中滴加饱和FeCl3溶液;在CuCl2溶液中滴加NaOH溶液 | 均为生成沉淀的复分解反应 |
A.AB.BC.CD.D