题目内容
11.已知元素R的某种同位素的氯化物RClx为离子化合物,其阳离子所含中子数为y,核外电子数为z,则该同位素的符号为( )| A. | ${\;}_{z}^{y}$R | B. | ${\;}_{z}^{y+z}$R | C. | ${\;}_{z+x}^{y+z}$R | D. | ${\;}_{z+x}^{y+z+x}$R |
分析 由离子化合物RClx知R离子带x个单位正电荷,即Rx+,R的核电荷数=x+z,质量数=核电荷数+中子数=(x+z)+y=x+z+y,然后根据原子符号的表示方法解答.
解答 解:由离子化合物RClx知R离子带x个单位正电荷,即Rx+,R的核电荷数=x+z,质量数=核电荷数+中子数=(x+z)+y=x+z+y,
所以该同位素的符号为:y+x+zx+zR,
故选D.
点评 本题主要考查了原子符号的含义及表示方法,题目难度不大,明确阳离子中质子数=核外电子数-电荷数、质量数=质子数+中子数为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.下列变化中,体现浓硫酸的脱水性和强氧化性的是( )
| A. | 盛装浓硫酸的烧杯敞口放置一段时间后质量增加 | |
| B. | 把铜片放入浓硫酸中并加热有气体产生 | |
| C. | 常温下可用铁、铝容器盛装浓硫酸 | |
| D. | 向蔗糖中加入浓硫酸,蔗糖变黑膨胀并有刺激性气味的气体放出 |
2.已知:元素的最高价氧化物的水化物酸性越强其非金属性就越强,则下列判断正确的是( )
| A. | 亚硫酸的酸性大于碳酸,故硫的非金属性大于碳 | |
| B. | 碳酸的酸性大于次氯酸,故碳的非金属性大于氯 | |
| C. | 硝酸的酸性大于硅酸,故氮的非金属性大于硅 | |
| D. | 氢氟酸的酸性大于氢氯酸,故氟的非金属性大于氯 |
19.下列有机物的名称肯定错误的是( )
| A. | 1,2-二溴丁烷 | B. | 2-甲基-3-丁烯 | ||
| C. | 3-乙基戊烷 | D. | 1,1,2,2--四溴乙烷 |
6.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
3.下列说法正确的是( )
| A. | 含有离子键和共价键的化合物一定是离子化合物 | |
| B. | 11H2O、12H2O、13H2O互为同位素 | |
| C. | 目前人们已发现的元素种类数目与原子种类数目相同 | |
| D. | 1H的质量数为1,所以氢元素的相对原子质量近似为1 |
20.下列分子式所表示的烃中,属于烷烃的是( )
| A. | C3H6 | B. | C4H6 | C. | C5H12 | D. | C6H6 |
1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断不正确的是( )
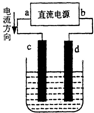

| A. | a为正极 | |
| B. | c极上发生氧化反应 | |
| C. | 电解过程中铜离子移向d极 | |
| D. | 电解过程中,d的电极反应式为:2Cl--2e-=Cl2↑ |