题目内容
根据铜与浓H2SO4反应的实验完成:(1)在试管里放一片_____色的铜片,加入2~3 mL浓H2SO4,铜片_____。
(2)给试管加热,铜片_____,有无色_____气体生成。
(3)用湿润蓝色石蕊试纸来检验所生成的气体,试纸_____色。
(4)反应一段时间后,停止加热,静置,溶液的颜色是_____,试管底部有_____色固体,把试管里的液体倒入盛有少量水的烧杯里,溶液显_____色。
(5)为了防止污染并节约原料,用Cu和浓H2SO4制取CuSO4的最佳方法是(用化学方程式表示) _______________,该方案最佳的原因是_______________。
(1)光亮紫红色 无明显变化
(2)溶解 刺激性气味
(3)变红
(4)无色 白 蓝
(5)2Cu+O2![]() 2CuO、CuO+H2SO4
2CuO、CuO+H2SO4![]() CuSO4+H2O H2SO4利用率高,产物无污染
CuSO4+H2O H2SO4利用率高,产物无污染
解析:Cu与浓H2SO4于常温下不反应,加热才反应生成CuSO4、SO2、H2O,因浓H2SO4吸水性强,吸收了生成的水,使CuSO4以无水盐晶体析出。若在加热条件下,向H2SO4和铜屑的混合体系中通入O2,O2将Cu氧化成CuO,CuO被H2SO4溶解生成CuSO4。

练习册系列答案
相关题目
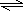 Cu(OH)2+2H+
Cu(OH)2+2H+
 研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
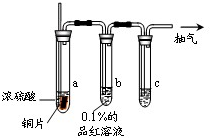 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空:
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空: